Hòa tan hoàn toàn 19,2 gam hỗn hợp X gồm Fe, FeO, Fe3O4 và Fe2O3 trong 400ml dung dịch HNO3 3M (dư) đun nóng,?
thu được dung dịch Y và V lít khí NO (dktc). NO là sản phẩm khử duy nhất của NO3-. cho 350 ml dung dịch NaOH 2M vào dung dịch Y thu được 21,4 gam kết tủa. giá trị của V là?Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D
![]()
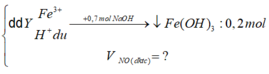
![]()
Coi hỗn hợp X ban đầu gồm Fe: x mol và O: y mol
Gọi nNO = z mol
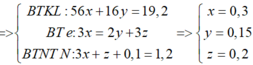
![]()

Đáp án D
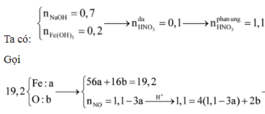
Theo giả thiết, ta có :

Quy đổi hỗn hợp X thành Fe và O. Theo bảo toàn khối lượng, bảo toàn electron, bảo toàn điện tích cho dung dịch Z và bảo toàn nguyên tố N, Fe, ta có :
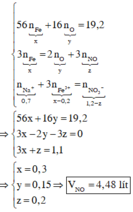

Định hướng tư duy giải :
Ta cùng nhau phân tích bài toán này chút các bạn nhé !
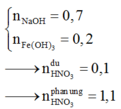
Vì HNO3 dư → NaOH sẽ tác dụng với (H+; Fe3+).Nhưng cuối cùng Na cũng biến thành NaNO3 và có thể có NaOH dư. Ta có ngay:
nNaOH = 1,3
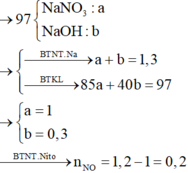
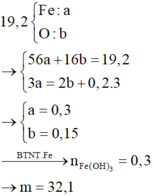

Đáp án : A
nFe(OH)3 = 0,1 mol = nFe bđ => mO(X) = 4g
Qui X về 0,1 mol Fe và 0,25 mol O
Bảo toàn e : 3nFe = 2nO + 3nNO
=> nNO < 0 (Vô lý)
=> Fe3+ còn dư so với OH-
=> nOH- = nHNO3 dư + 3nFe(OH)3 => nHNO3 dư = 0,05 mol
=> nHNO3 pứ = 0,6 – 0,05 = 0,55 mol
Bảo toàn e : 3nFe = 2nO + 3nNO ; nHNO3 = 3nFe + nNO
Lại có : 56nFe + 16nO = 9,6g
=> nFe = 0,15 ; nO = 0,075 mol => nNO = 0,1 mol
=> V= 2,24 lit

Đáp án : B
Nếu NaOH dư => n F e O H 3 = 0,2 mol
=> nFe(bd) = 0,2 mol
=> nO(bd) = 0,5 mol. Vô lý
(Vì số mol O trong oxit cao nhất là gấp 1,5 lần số mol Fe).
Vậy NaOH thiếu : 19,2 F e : a O : b
56a + 16b = 19,2
n H 2 S O 4 = 0 , 9
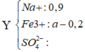
→ B T D T n S O 4 2 - = 0 , 3 + 3 a 2
→ B T N T . S n S O 2 = 0 , 9 - 0 , 3 + 3 a 2 a
6a – 2b = 1,5 ⇒ a = 0 , 3 b = 0 , 15 → V = 6 , 72

Đáp án : A
Do H2SO4 đặc dư => phản ứng tạo Fe3+
=> nkết tủa = nFe(OH)3 = 0,2 mol
Mà nNaOH = 0,9 mol > 3nFe(OH)3 => nOH trung hoà = 0,9 – 3.0,2 = 0,3 mol
=> nH2SO4 phản ứng X = 0,75 mol
Coi X gồm x mol Fe và y mol O
=> nH+ = 6nFe - 2nO = > 1,5 = 6x – 2y
, mX= 56x + 16y =19,2g
=> x = 0,3 mol ; y = 0,15 mol
=> BT e : nSO2.2 + nO.2= 3nFe => nSO2 = 0,3 mol
=> VSO2 = 6,72 lit

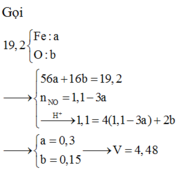
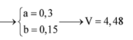


Quy đổi hỗn hợp về Fe và Fe2O3. Gọi n(Fe) = a (mol); n(Fe2O3) = b (mol)
Fe + 4HNO3 -> Fe(NO3)3 + NO + 2H2O
a............ 4a...............a..........a (mol)
Fe2O3 + 6HNO3 -> 2Fe(NO3)3 + 3H2O
b.................6b............. 2b (mol)
Ta có: 56a + 160b = 19,2 (1)
Do phản ứng trung hoà ưu tiên nên xảy ra trước.
NaOH + HNO3 -> NaNO3 + H2O (*)
0,1............0,1 (mol)
3NaOH + Fe(NO3)3 -> Fe(OH)3 + 3NaNO3 (**)
0,6.................................0,2 (mol)
n(kết tủa) = 0,2 mol => n(NaOH) (**) = 0,6 mol
=> n(NaOH) (*) = n(NaOH) - n(NaOH (**)) = 0,35.2 - 0,6 = 0,1 mol
Vậy ta có n(HNO3) = n(HNO3 phản ứng với hh) + n(HNO3 phản ứng với kiềm)
<=> 0,4.3 = 4a + 6b +0,1 (2)
(1)và(2) => a = 0,2
=> n(NO) = 0,2 => V = 4,48 (l)
Coi hỗn hợp Fe,Fe203 gồm 2 ngtố Fe, O.
Pứ thứ 1.
Do dư 0,24gFe nên toàn bộ (Fe3+) tạo thành sẽ chuyển thành Fe2+
=>ta có sơ đồ phản ứng:
a mol Fe,b mol 0+HN03-->0,02 mol N0+(Fe3+) --Fe dư--> Fe2+
ta có pt: 2a=2b+0,02.3 (¤)
pứ thứ2:
(Fe2+) +(H+)+(N03-) -->(Fe3+) +0,03 mol N0
=>n(Fe2+)=3nN0=0,09
(Đl bảo toàn e)
nFe=(nFe2+)=0,09=a
thay vào pt(¤) ta có
n0=b=0,06(mol)
…………………………………
TÍNH M
=>m =mFe+m0+m kimloại dư=0,09.56+0,06.16+0,24=6,24g
…………………………………
TÍNH V
xét p/ứ 1
。nFe203=n0/3=0,02
Fe203+6HN03 -> 2Fe(NO3)3
nHN03=6nFe203=0,12
có thêm nHN03=4NO=0,08(do ban đầu có Fe+HN03-->Fe3+)
=>nHN03=0,2
=>V=0,2/2=0,1L=100ml
P/s. vì ko phải giáo viên nên trình bày hơi khó hiểu chút mong bạn thông cảm nhé. Chúc bạn học tốt!