Hòa tan hoàn toàn 12,9 gam hỗn hợp Cu, Zn bằng dung dịch H2SO4 đặc, nóng thu được sản
phẩm khử là3,136 lít SO2 (đktc) và 0,64 gam lưu huỳnh. % khối lượng mỗi kim loại trong hỗn hợp
ban đầu là
A. 45,54% Cu; 54 46% Zn. B. 49,61% Cu; 50,39% Zn.
C. 50,15% Cu; 49,85% Zn. D. 51,08% Cu; 48,92% Zn.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Đặt nCu = x(mol); nZn=y(mol)
=> 64x + 65y = 12,9
Bảo toàn electron ta lại có: ne nhường = ne nhận
=> 2 . n Cu + 2 . n Zn = 2 n SO 2 + 6 n S
=> 2x + 2y = 0,4 => x = y = 0,1 (mol)
Vậy phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu là:
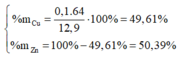

\(n_S = \dfrac{0,64}{32} = 0,02(mol)\)
Gọi \(n_{Cu} = a ; n_{Zn} = b\)
\(\Rightarrow 64a + 65b = 12,9(1)\)
Bảo toàn electron :
\(2n_{Cu} + 2n_{Zn} = 2n_{SO_2} + 6n_S\\ \Rightarrow 2a + 2b = 0,14.2 + 0,02.6(2)\)
Từ (1)(2) suy ra a = 0,1 ; b = 0,1
Vậy : \(\%m_{Cu} = \dfrac{0,1.64}{12,9}.100\% = 49,61\%\)

\(n_{SO_2}=\dfrac{13,644}{22,4}=0,61\left(mol\right)\)
Đặt n Fe = x (mol) =>\(m_{Fe}=56x\)
Vì m Fe = mMg => \(n_{Mg}=\dfrac{56x}{24}=\dfrac{7}{3}x\)
nAl = y(mol)
=> 56x + 56x + 27y = 16,14 (1)
\(Fe\rightarrow Fe^{3+}+3e\) \(S^{+6}+2e\rightarrow S^{+4}\)
\(Mg\rightarrow Mg^{2+}+2e\)
\(Al\rightarrow Al^{3+}+3e\)
Bảo toàn e : 3x + \(\dfrac{7}{3}.2x\) + 3y = 0,61.2 (2)
Từ (1), (2) => x=0,12 ; y=0,1
=> mFe =mMg=0,12.56 = 6,72(g)
m Al = 0,1.27=2,7(g)

Gọi $n_{Fe} = a ; n_{Mg} = b; n_{Al} = c$
Ta có :
$24b = 56a(1)$
$56a + 24b + 27c = 16,14(2)$
$n_{SO_2} = 0,61(mol)$
Bảo toàn electron : $3n_{Fe} + 2n_{Mg} + 3n_{Al} = 2n_{SO_2}$
$\Rightarrow 3a + 2b + 3c = 0,61.2(3)$
Từ (1)(2)(3) suy ra a = 0,12 ; b = 0,28 ; c = 0,1
$m_{Fe} = m_{Mg} = 0,12.56 = 6,72(gam)$
$m_{Al} = 0,1.27 = 2,7(gam)$

Đáp án A
Gọi số mol Fe là a; số mol O là b; số mol Cu là c
Khi đó 56a + 16b +64c = 2,44
Bảo toàn e có 3a + 2c =2b + 0,045
Khối lượng muối sunfat là 200a + 160c = 6,6
→ a = b = 0,025; c = 0,01


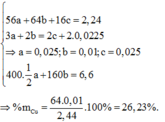

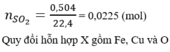
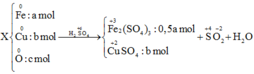
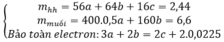
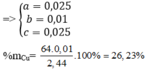
nSO2 = 0,15 mol
nS = 0,02 mol
Gọi số mol Cu và Zn lần lượt là x và y
=> 64x + 65y = 12,9 (I)
* Quá trình khử
0____+2
Cu -> Cu + 2e
x_________2x
0____+2
Zn -> Zn + 2e
y________2y
=> Tổng n e nhường = 2x + 2y (mol)
* Quá trình oxi hóa:
+4____+6
SO2 -> S + 2e
0,14______0,28
0___+6
S -> S + 6e
0,02___0,12
=> Tổng n e nhận = 0,28 + 0,12 = 0,4 (mol)
Theo định luật bảo toàn e: Tổng n e nhường = Tổng n e nhận
=> 2x + 2y = 0,4 (II)
Từ (I) và (II) => x = 0,1 và y = 0,1
=> %mCu = [(0,1.64)/12,9].100 = 49,61%
=> %mZn = 100 - 49,61 = 50,39%
=> Chọn B
n SO2=3,136/22,4=0,14, nS=0,64/32=0,02
Bảo toàn e: n Cu*2+ n Zn*2=n SO2*2+ n S*6
Gọi số mol của Cu ,Zn lần lượt là : x ,y.Ta có : 2x+2y=0,14*2+0,02*6=0,4
Gỉa thiết ban đầu:64x +65 y=12,9
Giai hệ pt này ta có :x=y=0,1
=>% m Cu=0,1*64*100/12,9=49,61%=> m Zn=100-49,61%=50,39%=> B