cho 1 dd axit sunfuric trong đó số mol H2SO4 =sỐ mol H2O .tính nồng độ %
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Giả sử số mol đều là x mol
=> mH2SO4=98x
mH2O=18x
C%H2SO4=\(\dfrac{98x}{98x+18x}.100=84,48\%\)

a)
$n_{Al} = \dfrac{5,4}{27} = 0,2(mol)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
Theo PTHH:
$n_{H_2SO_4} = n_{H_2} = \dfrac{3}{2}n_{Al} = 0,3(mol)$
$V_{dd\ H_2SO_4} = \dfrac{0,3}{2} = 0,15(lít)$
$n_{Al_2(SO_4)_3} = \dfrac{1}{2}n_{Al} = 0,1(mol)$
$C_{M_{Al_2(SO_4)_3}} = \dfrac{0,1}{0,15} = 0,67M$
b)
$V_{H_2} = 0,3.22,4 = 6,72(lít)$

1 thiếu m dd H2SO4 hoặc D nhé
2
\(a\) \(n_{HCl}=\dfrac{3,65}{36,5}=0,1mol\)
\(C_{M_{HCl}}=\dfrac{0,1}{0,2}=0,5M\)
\(b\) \(C_{M_{H_2SO_4}}=\dfrac{0,2}{0,2}=1M\)

a)
$Fe + H_2SO_4 \to FeSO_4 + H_2$
Theo PTHH :
$n_{Fe} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$m_{Fe} = 0,15.56 = 8,4(gam)$
b)
$n_{H_2SO_4} = n_{H_2} = 0,15(mol)$
$C_{M_{H_2SO_4}} = \dfrac{0,15}{0,05} = 3M$
c)
$n_{FeSO_4} = n_{H_2} = 0,15(mol)$
$C_{M_{FeSO_4}} = \dfrac{0,15}{0,05} = 3M$

a, \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b, \(n_{Fe}=\dfrac{1,12}{56}=0,02\left(mol\right)\)
\(n_{H_2SO_4}=0,2.0,12=0,024\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,02}{1}< \dfrac{0,024}{1}\), ta được H2SO4 dư.
Theo PT: \(n_{H_2SO_4\left(pư\right)}=n_{FeSO_4}=n_{Fe}=0,02\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=0,024-0,02=0,004\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{FeSO_4}}=\dfrac{0,02}{0,2}=0,1\left(M\right)\\C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0,004}{0,2}=0,02\left(M\right)\end{matrix}\right.\)

Nồng độ mol của dung dịch H 2 SO 4 :
n H 2 SO 4 = n SO 3 = 8/80 = 0,1 mol
Theo phương trình hoá học :
C Mdd H 2 SO 4 = 1000x0,1/250 = 0,4M
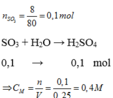
Giả sử số mol đều là x mol
\(m_{H_2SO_4}=98x\)
\(m_{H_2O}=18x\)
\(C\%_{H_2SO_4}=\dfrac{98x.100}{98x+18x}=\dfrac{9800}{116}\approx85,5\%\)
cảm mơn bn yêu nha