Cho 224,0 ml CO2 (đktc) hấp thụ hết trong 100 ml dung dịch kali hidroxit 0,2M. Tính khối lượng của những chất có trong dung dịch tạo thành.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Ta có tỉ lệ:
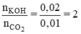
⇒ Phương trình tạo muối trung hoà
CO2 + 2KOH → K2CO3 + H2O
⇒ Dung dịch sau phản ứng có
mK2CO3 = 0,01.138 = 1,38 g

nCO2 = 0,224:22,4 = 0,01 (mol);
nKOH = 0,1 x 0,2 = 0,02 (mol)
2 KOH + CO2 → K2CO3 + H2O
\(\frac{n_{KOH}}{n_{CO2}}=\frac{0,02}{0,01}=2\)
Trong dung dịch sau phản ứng chỉ có K2CO3:
mK2CO3 = 0,01. 138 = 1,38 (g)
BÀI NÀY DỄ MÀ
=
= 0,0100 (mol); nKOH = 1,00 x 0,200 = 0,0200 (mol)
2 KOH + CO2 → K2CO3 + H2O
=
= 2
Trong dung dịch sau phản ứng chỉ có K2CO3: = 0,01. 138 = 1,38 (g)

số mol CO2 = 0.224/22.4 = 0.01 mol
số mol KOH = 0.1*0.2 = 0.02 mol
ptpu
CO2 + 2 KOH = K2CO3
0.01 mol 0.02 mol 0.01 mol
các chất đều tham gia pư hết ngaylanb đầu ko còn chất nào dư
vậy dd tạo thành chỉ có K2CO3
m = 0.01* ( 39*2 + 12 + 16*3 ) = 0.01*138 = 1.38 gam
Chúc bạn học tốt ^^

Đáp án A
Ta có: nCO2= 0,224/22,4= 0,01 mol;
nKOH= 0,1.0,2= 0,02 mol
→ CO2 tác dụng với KOH tạo muối trung hòa theo PTHH:
CO2+ 2KOH → K2CO3+ H2O
0,01 0,02 0,01 mol
→mK2CO3= 0,01.138= 1,38 gam

nCO2nCO2 =0,22422,40,22422,4 = 0,0100 (mol); nKOH = 1,00 x 0,200 = 0,0200 (mol)
2 KOH + CO2 → K2CO3 + H2O
nKOHnCO2nKOHnCO2 = 0,02000,01000,02000,0100 = 2,00
Trong dung dịch sau phản ứng chỉ có K2CO3: mK2CO3mK2CO3 = 0,01. 138 = 1,38 (g)

$n_{CO_2} = 0,02(mol) = n_{KOH} = 0,1.0,02$
Suy ra :
$KOH + CO_2 \to KHCO_3$
Theo PTHH : $n_{KHCO_3} = n_{CO_2} = 0,02(mol)$
$m_{KHCO_3} = 0,02.100 =2 (gam)$

Bài 1 :
$n_{CO_2} = \dfrac{3,136}{22,4} = 0,14(mol)$
$n_{Ca(OH)_2} = 0,8.0,1 = 0,08(mol)$
CO2 + Ca(OH)2 → CaCO3 + H2O
0,08.......0,08...........0,08........................(mol)
CaCO3 + CO2 + H2O → Ca(HCO3)2
0,06........0,06........................................(mol)
Suy ra : $m_{CaCO_3} = (0,08 - 0,06).100 = 2(gam)$
Bài 2 :
$n_{CO_2} = \dfrac{2,24}{22,4} = 0,1(mol) ; n_{NaOH} = 0,1.1,5 = 0,15(mol)$
2NaOH + CO2 → Na2CO3 + H2O
0,15........0,075.......0,075....................(mol)
Na2CO3 + CO2 + H2O → 2NaHCO3
0,025........0,025...................0,05..............(mol)
Suy ra:
$C_{M_{NaHCO_3}} = \dfrac{0,05}{0,1} = 0,5M$
$C_{M_{Na_2CO_3}} = \dfrac{0,075 - 0,025}{0,1} = 0,5M$
b)
$NaOH + HCl \to NaCl + H_2O$
$n_{HCl} = n_{NaOH} = 0,15(mol)$
$m_{dd\ HCl} = \dfrac{0,15.36,5}{25\%} = 21,9(gam)$

Ta có: \(\left\{{}\begin{matrix}n_{CO_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\\n_{KOH}=0,15\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) KOH dư, tạo muối trung hoà
PTHH: \(CO_2+2KOH\rightarrow K_2CO_3+H_2O\)
Theo PTHH: \(n_{K_2CO_3}=0,05\left(mol\right)=n_{KOH\left(dư\right)}\) \(\Rightarrow\left\{{}\begin{matrix}m_{K_2CO_3}=0,05\cdot138=6,9\left(g\right)\\m_{KOH}=0,05\cdot56=2,8\left(g\right)\end{matrix}\right.\)
$n_{KOH} = 0,1.0,2 = 0,02(mol) ; n_{CO_2} = \dfrac{224}{1000.22,4} = 0,01(mol)$
Ta thấy : $n_{KOH} : n_{CO_2} = 0,02 : 0,01 = 2$ nên tạo thành muối trung hòa
$2KOH + CO_2 \to K_2CO_3 + H_2O$
$n_{K_2CO_3} = n_{CO_2} = 0,01(mol)$
$m_{K_2CO_3} = 0,01.138 = 1,38(gam)$