Cho 33,8g H2so4.3SO3 hòa tan hoàn toàn vào 800ml dung dịch H2SO4 19%, D=1.25g/ml tạo ra dung dịch A. Tính C% của dung dịch A
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a, PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b, Ta có: \(n_{Fe}=\dfrac{19,6}{56}=0,35\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Fe}=0,35\left(mol\right)\Rightarrow V_{H_2}=0,35.22,4=7,84\left(l\right)\)
c, \(n_{H_2SO_4}=n_{Fe}=0,35\left(mol\right)\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,35}{0,2}=1,75\left(M\right)\)
d, \(n_{FeSO_4}=n_{Fe}=0,35\left(mol\right)\Rightarrow m_{FeSO_4}=0,35.152=53,2\left(g\right)\)
e, \(C_{M_{FeSO_4}}=\dfrac{0,35}{0,2}=1,75\left(M\right)\)
d, \(n_{H_2SO_4}=0,25.1,6=0,4\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{n_{Fe}}{1}< \dfrac{n_{H_2SO_4}}{1}\), ta được H2SO4 dư.
Theo PT: \(n_{H_2SO_4\left(pư\right)}=n_{Fe}=0,35\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=0,4-0,35=0,05\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4\left(dư\right)}=0,05.98=4,9\left(g\right)\)

a) \(n_K=\dfrac{3,9}{39}=0,1\left(mol\right)\)
PTHH: 2K + 2H2O → 2KOH + H2
Mol: 0,1 0,1 0,05
\(V_{H_2}=0,05.22,4=1,12\left(l\right)\)
\(C\%_{ddKOH}=\dfrac{0,1.56.100\%}{3,9+52,2-0,05.2}=10\%\)
b,
PTHH: 2KOH + H2SO4 → K2SO4 + H2O
Mol: 0,1 0,05
\(V_{ddH_2SO_4}=\dfrac{0,05}{0,8}=0,0625\left(l\right)=62,5\left(ml\right)\)
\(n_K=\dfrac{3,9}{39}=0,1\left(mol\right)\\ 2K+2H_2O\rightarrow2KOH+H_2\\ 0,1.......0,1........0,1..........0,05\left(mol\right)\\ a.V_{H_2\left(đktc\right)}=0,05.22,4=1,12\left(l\right)\\ m_{ddKOH}=3,9+52,2-0,05.2=56\left(g\right)\\ C\%_{ddKOH}=\dfrac{0,1.56}{56}.100=10\%\\ b.H_2SO_4+2KOH\rightarrow K_2SO_4+2H_2O\\ 0,05.........0,1..........0,05...........0,1\left(mol\right)\\ V_{ddH_2SO_4}=\dfrac{0,05}{0,8}=0,0625\left(l\right)=62,5\left(ml\right)\)

H2SO4 + nSO3 => H2SO4.nSO3
H2SO4.nSO3 + nH2O >> n+1H2SO4
H2SO4 + 2NaOH >> Na2SO4 + 2H2O
Số mol NaOH = 0,008 , số mol H2SO4 200ml = 0,008/2 . 200/10 =0,08
Theo (2) nH2SO4.nSO3 =0,08/n+1
MH2SO4.nSO3 =98 +80n = 6,76/0,08/n+1 =84,5n+ 84,5
13,5 =4,5n
=>n=3
%SO3=3.80/2.80+98 =71%
c,Theo câu b , hàm lượng % của SO3 có trong oleum trên là 71
Cứ 100g oleum có 71g SO3 và 29g H2SO4 Khi đó mdd = 1,31.100 = 131g
a g có 71a/100 ...............29a/100
Vì dd H2SO4 có C=40%
Cứ 100g dd có 40g H2SO4 và 60g H2O
=>131g >> 131.40/100 = 52,4g H2SO4 và 131.60/100 = 78,6 g H2O
Khi cho oleum vào dd H2SO4 thì SO3+H2O
SO3 + H2O >> H2SO4
Cứ 80g cần 18g >> 98g
Vậy ..x..g cần 78,6g >>..y..g
x= 78,6.80/18 = 349,3g
y= 78,6.98/18 = 427,9g
Trong loại oleum mới 10% thì mSO3 = 71a/100 -349,3g
và mH2SO4 = 29a/100 +52,4+ 427,9
=> 71a/100 -349,4 / 29a/100 +480,3 = 10/90
=> Bạn ấn máy tìm a nhé

\(A.2NaOH+H_2SO_4\rightarrow Na_2SO_4+H_2O\\ n_{NaOH}=0,04.1=0,04mol\\ n_{H_2SO_4}=0,04:2=0,02mol\\ C_{M\left(H_2SO_4\right)}=\dfrac{0,02}{0,05}=0,4M\)
Cho quỳ tím vào dd \(H_2SO_4\) rồi nhỏ từ từ dd \(NaOH\) vào. Đến khi thấy quỳ tím từ màu đỏ trở về màu tím thì đó là thời điểm \(H_2SO_4\) được trung hoà hoàn toàn.

Giải thích:
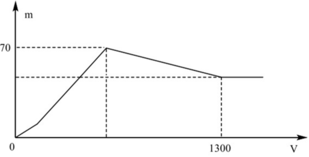
Giả sử số mol ban đầu: nAl = x mol, nBa(OH)2 = y mol
2Al + Ba(OH)2 + 2H2O→ Ba(AlO2)2 + 3H2
x 0,5x 0,5x
Dung dịch X: Ba(AlO2)2 (0,5x mol) và Ba(OH)2 dư (y-0,5x mol)
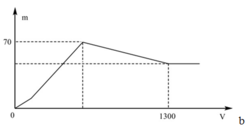
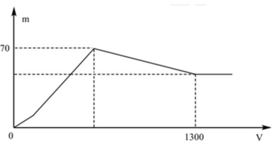
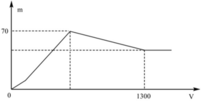
+ Khi kết tủa lớn nhất: m↓ = mAl(OH)3 max + mBaSO4 max = 78x + 233y = 70 (1)
+ Khi V= 1300 ml: Al(OH)3 vừa bị hòa tan hết. Khi đó ta có:
OH- + H+ → H2O
H+ + AlO2- + H2O → Al(OH)3
3H+ + Al(OH)3 → Al3+ + 3H2O
nH+ = nOH- dư + nAlO2- + 3nAl(OH)3 max => 2.1,3.0,5 = 2y – x + x + 3x <=> 3x + 2y = 1,3 (2)
Giải (1) và (2): x = 0,3; y = 0,2
=> a = 0,3.27 = 8,1 gam
Đáp án A

Đáp án A
Quan sát nhanh: đoạn OAB có điểm gấp khúc tại A => Cho biết X gồm Ba(AlO2)2 và Ba(OH)2
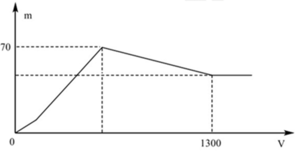



Đáp án B
Chọn n A g = 4
TN1: n f r u c t o z ơ = 2 → m1 = 360 gam
TN2: n g l u c o z ơ = n f r u c t o z ơ = 1 → n s a c c a r o z ơ = 1 → m2 = 1∙342/75% = 456 gam
→ m1/m2 = 15/19 → 19m1 = 15m2

Đáp án A
Giả sử số mol ban đầu: nAl = x mol, nBa(OH)2 = y mol
2Al + Ba(OH)2 + 2H2O→ Ba(AlO2)2 + 3H2
x 0,5x 0,5x
Dung dịch X: Ba(AlO2)2 (0,5x mol) và Ba(OH)2 dư (y-0,5x mol)
+ Khi kết tủa lớn nhất: m↓ = mAl(OH)3 max + mBaSO4 max = 78x + 233y = 70 (1)
+ Khi V= 1300 ml: Al(OH)3 vừa bị hòa tan hết. Khi đó ta có:
OH- + H+ → H2O
H+ + AlO2- + H2O → Al(OH)3
3H+ + Al(OH)3 → Al3+ + 3H2O
nH+ = nOH- dư + nAlO2- + 3 nAl(OH)3 max => 2.1,3.0,5 = 2y – x + x + 3x <=> 3x + 2y = 1,3 (2)
Giải (1) và (2): x = 0,3; y = 0,2
=> a = 0,3.27 = 8,1 gam
\(n_{H_2SO_4.3SO_3}=\dfrac{33,8}{338}=0,1mol\) suy ra có 0,1 mol H2SO4 và 0,3 mol SO3
-Trong 800 ml dung dịch H2SO4 có số mol là:
\(n_{H_2SO_4}=\dfrac{800.1,25.19}{98.100}\approx1,94mol\)
SO3+H2O\(\rightarrow\)H2SO4
\(n_{H_2SO_4}=0,1+0,3+1,94=2,34mol\)
\(C\%_{H_2SO_4}=\dfrac{2,34.98.100}{33,8+800.1,25}\approx22,18\%\)