1 - Tính C% các chất trong dd trog phản ứng sau: Trộn 300g dung dịch HCl 7,3% với 200g dd NaOH 4%.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Khối lượng chất tan HCl là: 300 . 7,3% = 21,9 gam
Khối lượng chất tan NaOH là: 200.4% = 8 gam
PTHH: HCl + NaOH → NaCl + H2O
Số mol của HCl là: 21,9 : 36,5 = 0,6 mol
Số mol của NaOH là: 8 : 40 = 0,2 mol
So sánh : 0,2 < 0,6
=> HCl dư. Tính theo NaOH
Số mol của NaCl tính theo pt là: 0,2 mol
Khối lượng NaCl là: 0,2 . 59,5 = 11,9 gam
Khối lượng dung dịch sau phản ứng là: 300 + 200 = 500 gam
C% NaCl trong dung dịch sau phản ứng là:
(11,9 : 500) . 100% = 2,38%
n HCl =300*0.073/36.5 =0.6(mol)
n NaOH =200*0.04/40 =0.2(mol)
pt:
NaOH+ HCl---> NaCl + H2O
ta có tỉ lệ: 0.6/1>0.2/1 nên HCl dư và dư 0.6-0.2=0.4mol. '
dd sau chứa 0.2 mol NaCl và 0.4 mol HCl
C% NaCl= 0.2*58.5/500=2.34%
C% HCl= 0.4*36.5/500=2.92%

\(NaCl + HCl \to NaCl + H_2O\\ n_{HCl} = \dfrac{300.7,3\%}{36,5} = 0,6 > n_{NaOH} = \dfrac{200.4\%}{40} =0,2\to HCl\ dư\\ n_{HCl\ pư} = n_{NaCl} = n_{NaOH} = 0,2(mol)\\ n_{HCl\ dư} = 0,6 - 0,2 = 0,4(mol)\\ m_{dd\ sau\ pư} = 300 + 200 = 500(gam)\\ C\%_{NaCl} = \dfrac{0,2.58,5}{500}.100\% =2,34\%\\ C\%_{HCl} = \dfrac{0,4.36,5}{500}.100\% = 2,92\%\)
PTHH: NaOH + HCl -> NaCl + H2O
Ta có:
\(m_{HCl}=\dfrac{m_{ddHCl}.C\%_{ddHCl}}{100\%}=\dfrac{300.7,3}{100\%}=21,9\left(g\right)\)
\(\Rightarrow n_{HCl}=\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{21,9}{36,5}=0,6\left(mol\right)\)
\(m_{NaOH}=\dfrac{m_{ddNaOH}.C\%_{ddNaOH}}{100\%}=\dfrac{200.4}{100\%}=8\left(g\right)\)
\(\Rightarrow n_{NaOH}=\dfrac{m_{NaOH}}{M_{NaOH}}=\dfrac{8}{40}=0,2\left(mol\right)\)
Theo PTHH và đề bài, ta có:
\(\dfrac{n_{HCl\left(đề\right)}}{n_{HCl\left(PTHH\right)}}=\dfrac{0,6}{1}>\dfrac{n_{NaOH\left(đề\right)}}{n_{NaOH\left(PTHH\right)}}=\dfrac{0,2}{1}\)
=> HCl dư, NaOH hết, tính theo nNaOH.
Chất có trong dung dịch sau khi phản ứng kết thúc là HCl dư và NaCl.
Theo PTHH và đề bài, ta có:
\(n_{HCl\left(phảnứng\right)}=n_{NaCl}=n_{NaOH}=0,2\left(mol\right)\)
\(\Rightarrow n_{HCl\left(dư\right)}=n_{HCl\left(banđầu\right)}-n_{HCl\left(phảnứng\right)}=0,6-0,2=0,4\left(mol\right)\)

\(n_{NaOH}=\dfrac{200.4\%}{40}=0,2\left(mol\right)\\ n_{HCl}=\dfrac{200.7,3\%}{36,5}=0,4\left(mol\right)\\ NaOH+HCl\rightarrow NaCl+H_2O\\ m_{ddsau}=200+200=400\left(g\right)\\ Vì:\dfrac{0,2}{1}< \dfrac{0,4}{1}\Rightarrow HCldư\\ n_{HCl\left(p.ứ\right)}=n_{NaCl}=n_{NaOH}=0,2\left(mol\right)\\ n_{HCl\left(dư\right)}=0,4-0,2=0,2\left(mol\right)\\ C\%_{ddHCl\left(dư\right)}=\dfrac{0,2.36,5}{400}.100=1.825\%\\ C\%_{ddNaCl}=\dfrac{0,2.58,5}{400}.100=2,925\%\)

PTHH: NaOH + HCl -> NaCl + H2O
Ta có: \(m_{HCl}=\dfrac{m_{ddHCl}.C\%_{ddHCl}}{100\%}=\dfrac{300.7,3}{100}=21,9\left(g\right)\\ =>n_{HCl}=\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{21,9}{36,5}=0,6\left(mol\right)\\ m_{NaOH}=\dfrac{m_{ddNaOH}.C\%_{ddNaOH}}{100\%}=\dfrac{200.4}{100}=8\left(g\right)\\ =>n_{NaOH}=\dfrac{m_{NaOH}}{M_{NaOH}}=\dfrac{8}{40}=0,2\left(mol\right)\)
Theo PTHH và đề bài, ta có:
\(\dfrac{n_{HCl\left(đê\right)}}{n_{HCl\left(PTHH\right)}}=\dfrac{0,6}{1}>\dfrac{n_{NaOH\left(đề\right)}}{n_{NaOH\left(PTHH\right)}}=\dfrac{0,2}{1}\)
=> HCl dư, NaOH hết, tính theo nNaOH.
Chất có trong dung dịch sau khi phản ứng kết thúc là HCl dư và NaCl.
Theo PTHH và đề bài, ta có:
\(n_{HCl\left(phảnứng\right)}=n_{NaCl}=n_{NaOH}=0,2\left(mol\right)\\ =>n_{HCl\left(dư\right)}=n_{HCl\left(banđầu\right)}-n_{HCl\left(phảnứng\right)}=0,6-0,2=0,4\left(mol\right)\\ =>m_{NaCl}=n_{NaCl}.M_{NaCl}=0,2.58,5=11,7\left(g\right)\\ m_{HCl\left(dư\right)}=n_{HCl\left(dư\right)}.M_{HCl}=0,4.36,5=14,6\left(g\right)\)
Theo ĐLBTKL, ta có:
\(m_{ddthuđược}=m_{ddHCl}+m_{ddNaOH}=300+200=500\left(g\right)\)
Nồng độ phần trăm các chất có trong dung dịch sau khi phản ứng kết thúc:
\(C\%_{ddHCl\left(dư\right)}=\dfrac{m_{HCl}}{m_{ddthuđược}}.100\%=\dfrac{14,6}{500}.100=2,92\%\)
\(C\%_{ddNaCl}=\dfrac{m_{NaCl}}{m_{ddthuđược}}.100\%=\dfrac{11,7}{500}.100=2,34\%\)

a) Từ công thức tính nồng độ phần trăm ta có:
mHCl=C%.mddHCl= 7,3%.300=21,9(g)
mNaOH=C%.mddNaOH=4%.200=8(g)
=> C%=\(\frac{21,9+8}{300+200}.100\%=5,98\%\)
b) Từ công thức tính nồng độ phần trăm ta có
mCuSO4=C%.mddCuSO4=5%.500=25(g)
=> mH2O=500-25=475(g)

\(m_{HCl}=\dfrac{300.7,3\%}{100\%}=21,9g\\ n_{HCl}=\dfrac{21,9}{36,5}=0,6mol\\ HCl+NaOH\rightarrow NaCl+H_2O\left(1\right)\\ n_{NaOH\left(1\right)}=n_{HCl}=0,6mol\\ m_{H_2SO_4}=\dfrac{200.9,8\%}{100\%}=19,6g\\ n_{H_2SO_4}=\dfrac{19,6}{98}=0,2mol\\ H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O\left(2\right)\\ n_{NaOH\left(2\right)}=0,2.2=0,4mol\\ n_{NaOH}=0,4+0,6=1mol\\ m_{NaOH}=1.40=40g\\ m_{ddNaOH}=\dfrac{40}{5\%}\cdot100\%=800g\)

NaOH + HCl -> NaCl + H2O (1)
nHCl=0,6(mol)
nNaOH=0,2(mol)
=> Sau PƯ còn 0,4 mol HCl dư
Từ 1:
nNaCl=nNaOH=0,2(mol)
mNaCl=0,2.58,5=11,7(g)
mHCl dư=0,4.36,5=14,6(g)
C% dd NaCl=\(\dfrac{11,7}{500}.100\%=2,34\%\)
C% dd HCl dư=\(\dfrac{14,6}{500}.100\%=2,92\%\)


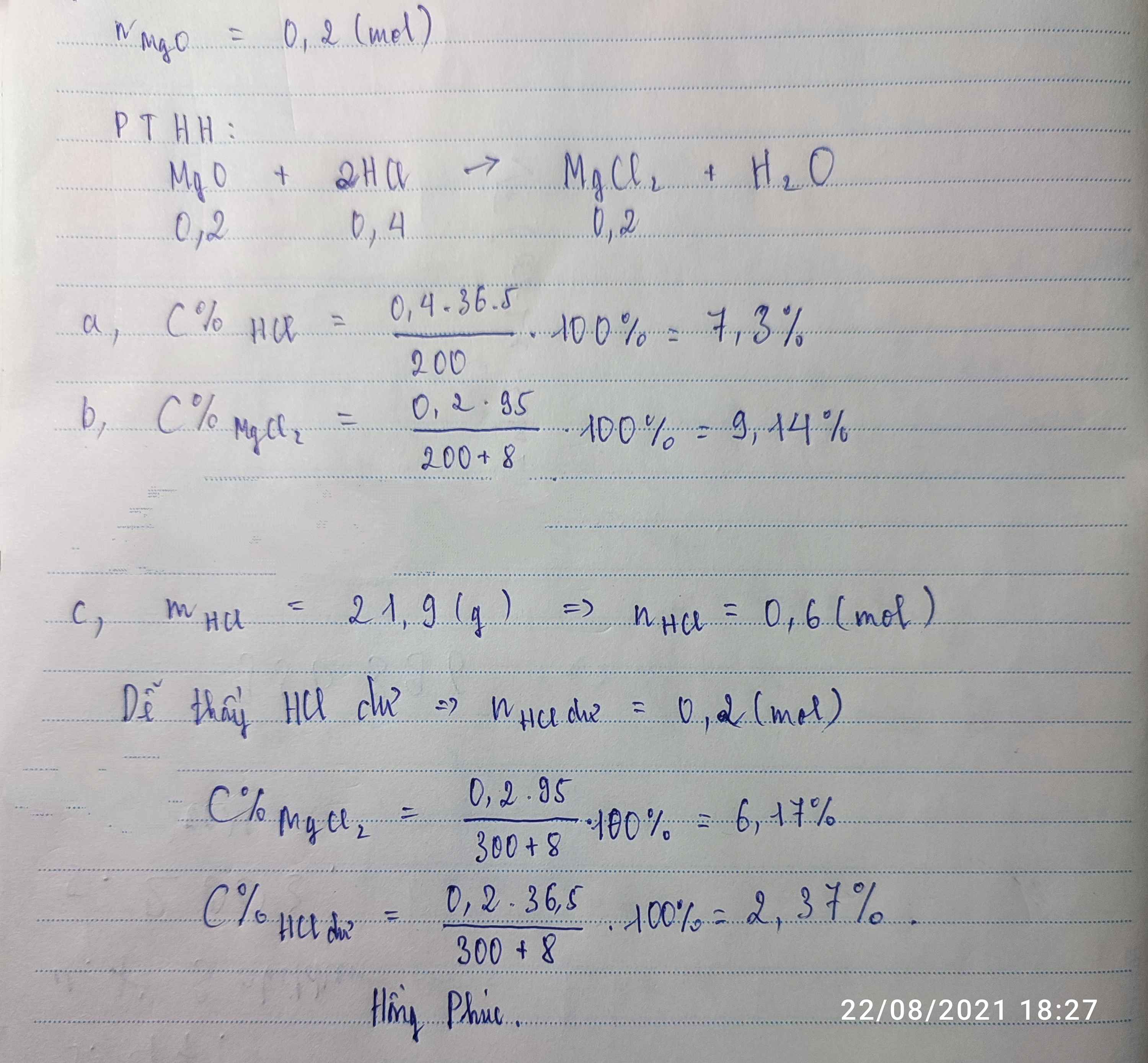
Khối lượng chất tan HCl là: 300 . 7,3% = 21,9 gam
Khối lượng chất tan NaOH là: 200.4% = 8 gam
PTHH: HCl + NaOH → NaCl + H2O
Số mol của HCl là: 21,9 : 36,5 = 0,6 mol
Số mol của NaOH là: 8 : 40 = 0,2 mol
So sánh : 0,2 < 0,6
=> HCl dư. Tính theo NaOH
Số mol của NaCl tính theo pt là: 0,2 mol
Khối lượng NaCl là: 0,2 . 59,5 = 11,9 gam
Khối lượng dung dịch sau phản ứng là: 300 + 200 = 500 gam
C% NaCl trong dung dịch sau phản ứng là:
(11,9 : 500) . 100% = 2,38%
Khối lượng chất tan dd HCl là: 300 . 7,3% = 21,9g
Khối lượng chất tan dd NaOH là: 200 . 4% = 8g
PTHH: HCl + NaOH --> NaCl + H2O
Số mol của HCl là: 21,9 : 36,5 = 0,6 mol
Số mol của NaOH là: 8 : 40 = 0,2 mol
Mà 0,6 > 0,2 => HCl dư. Tính theo NaOH,
Số mol của NaCl tính theo PT là 0,2 mol
Khối lượng NaCl là: 0,2 . 59,5 = 11,9g
Khối lượng dd sau phản ứng là: 300 + 200 = 500g
C% NaCl trong dd sau phản ứng là: (11,9 : 500) . 100% = 2,38%