Nhúng thanh sắt có khối lượng 50g vào 500ml dung dịch CuSO4. Sau một thời gian khối lượng thanh sắt tăng 4%.Tính nồng độ mol/lít của dung dịch CuSO4
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Khối lượng thanh sắt tăng: 50x4/100 = 2(g). Gọi khối lượng sắt tác dụng là x gam
Phương trình hóa học của phản ứng:
Fe + CuSO 4 → FeSO 4 + Cu
Theo phương trình hóa học trên và đề bài, ta có:
64x/56 - x = 2
=> x= 14g; n Fe = 14/56 = 0,25 mol
Vậy khố lượng Cu sinh ra là 16 gam
Fe + CuSO 4 → FeSO 4 + Cu
n FeSO 4 = n Fe = 0,25
C M FeSO 4 = 0,25/0,5 = 0,5M

nCu= \(\frac{0,64}{64}\) = 0,01 mol
PTHH:
Fe + CuSO4 → FeSO4 + Cu↓
0,01___0,01_____________0,01
\(\text{m t h a n h s ắ t t ă n g = 0,01 . (64- 56)=0,08 g}\)
a=\(\frac{0,08}{50}\).100%=0,16 %'
\(CM_{CuSO4}=\frac{0,01}{0,5}=0,02M\)


Theo (1) có khối lượng Cu bám vào: mCu = 0,4.2,5.64 = 64 (gam)
Theo (2) có khối lượng Cu bám vào: mCu = 0,4.64 =25,6 (gam).
Đáp án A

Gọi $n_{Fe\ pư} = a(mol)$
$Fe + CuSO_4 \to FeSO_4 + Cu$
$n_{Cu} = n_{Fe} = a(mol)$
Suy ra: $8 - 56a + 64a = 8,8 \Rightarrow a = 0,1(mol)$
$n_{FeSO_4} = n_{Fe} =a = 0,1(mol)$
$n_{CuSO_4\ dư} = 0,5.2 - 0,1 = 0,9(mol)$
$C_{M_{FeSO_4}} = \dfrac{0,1}{0,5} = 0,2M$
$C_{M_{CuSO_4}} = \dfrac{0,9}{0,5} = 1,8M$

Fe +CuSO4 → FeSO4 + Cu
Khối lượng thanh sắt tăng thêm đúng bằng khối lượng Cu thêm vào trừ đi khối lượng Fe tham gia phản ứng.
Gọi số mol của Fe tham gia phản ứng là x (mol)
Ta có : 64x−56x=51−50=1
=> x=0,125 (mol)
=> n CuSO4 pứ = n Fe(pứ) = 0,125 (mol)
\(CM_{CuSO_4}=\dfrac{0,125}{0,1}=1,25M\)
n FeSO4 = n Fe(pứ) = 0,125 (mol)
\(CM_{FeSO_4}=\dfrac{0,125}{0,1}=1,25M\)

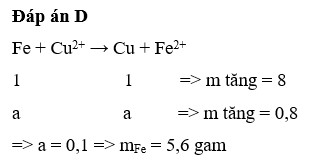
Fe + CuSO4 \(\rightarrow\)FeSO4 + Cu
mtăng=50.\(\dfrac{4}{100}=2\left(g\right)\)
Gọi số mol sắt PƯ là x
Ta có:
mCu-mFe=2
64x-56x=2
=>x=0,25
Theo PTHH ta có:
nFe=nCuSO4=0,25(mol)
CM dd CuSO4=\(\dfrac{0,25}{0,5}=0,5M\)