Chia 19,8 gam Zn(OH)2 thành hai phần bằng nhau:
a. Cho 150 ml dung dịch H2SO4 1M vào phần một. Tính khối lượng muối tạo thành.
b. Cho 150 ml dung dịch NaOH 1M vào phần hai. Tính khối lượng muối tạo thành.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nAl(OH)3= 15.6/78=0.2 mol
PI : nH2SO4= 0.2 mol
2Al(OH)3 + 3H2SO4 --> Al2(SO4)3 + 6H2O
Bđ: 0.2_________0.2
Pư : 1/15________0.2_________1/15
Kt: 2/15_________0___________1/15
mAl2(SO4)3= 1/15*342= 22.8g
PII:
nNaOH = 0.05 mol
NaOH + Al(OH)3 --> NaAlO2 + 2H2O
Bđ: 0.05_____0.2
Pư: 0.05_____0.05______0.05
Kt: 0________0.15______0.05
mNaAlO2= 0.05*82=4.1g
a) \(n_{H_2SO_4}=0,2\times1=0,2\left(mol\right)\)
\(m_{Al\left(OH\right)_3}=\frac{1}{2}\times15,6=7,8\left(g\right)\)
\(\Rightarrow n_{Al\left(OH\right)_3}=\frac{7,8}{78}=0,1\left(mol\right)\)
PTHH: 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
Theo PT: \(n_{Al\left(OH\right)_3}=\frac{2}{3}n_{H_2SO_4}\)
Theo bài: \(n_{Al\left(OH\right)_3}=\frac{1}{2}n_{H_2SO_4}\)
Vì \(\frac{1}{2}< \frac{2}{3}\) ⇒ H2SO4 dư
Theo PT: \(n_{Al_2\left(SO_4\right)_3}=\frac{1}{2}n_{Al}=\frac{1}{2}\times0,1=0,05\left(mol\right)\)
\(\Rightarrow m_{Al_2\left(SO_4\right)_3}=0,05\times342=17,1\left(g\right)\)
b) \(n_{NaOH}=0,05\times1=0,05\left(mol\right)\)
\(m_{Al\left(OH\right)_3}=\frac{1}{2}\times15,6=7,8\left(g\right)\)
\(\Rightarrow n_{Al\left(OH\right)_3}=\frac{7,8}{78}=0,1\left(mol\right)\)
PTHH: Al(OH)3 + NaOH → NaAlO2 + 2H2O
Theo PT: \(n_{Al\left(OH\right)_3}=n_{NaOH}\)
Theo bài : \(n_{Al\left(OH\right)_3}=2n_{NaOH}\)
Vì \(2>1\) → Al(OH)3 dư
Theo Pt: \(n_{NaAlO_2}=n_{NaOH}=0,05\left(mol\right)\)
\(\Rightarrow m_{NaAlO_2}=0,05\times82=4,1\left(g\right)\)

\(PTHH:Na_2CO_3+H_2SO_4\rightarrow Na_2SO_4+H_2O+CO_2\\ CO_2+KOH\rightarrow KHCO_3\\ \Rightarrow n_{H_2SO_4}=n_{CO_2}=1\cdot0,2=0,2\left(mol\right)\\ m_{KOH}=\dfrac{98\cdot40\%}{100\%}=39,2\left(g\right)\\ \Rightarrow n_{KOH}=\dfrac{39,2}{56}=0,7\left(mol\right)\)
Do đó sau phản ứng, KOH dư
\(\Rightarrow n_{KHCO_3}=n_{CO_2}=0,2\left(mol\right)\\ \Rightarrow m_{KHCO_3}=0,2\cdot100=20\left(g\right)\)

a, \(Na_2SO_3+H_2SO_4\rightarrow Na_2SO_4+SO_2+H_2O\)
\(K_2SO_3+H_2SO_4\rightarrow K_2SO_4+SO_2+H_2O\)
Ta có: \(n_{SO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{SO_2}=0,3\left(mol\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,3.98}{20\%}=147\left(g\right)\)
b, Ta có: 126nNa2SO3 + 158nK2SO3 = 44,2 (1)
Theo PT: \(n_{SO_2}=n_{Na_2SO_3}+n_{K_2SO_3}=0,3\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Na_2SO_3}=0,1\left(mol\right)\\n_{K_2SO_3}=0,2\left(mol\right)\end{matrix}\right.\)
Có: m dd sau pư = 44,2 + 147 - 0,3.64 = 172 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{Na_2SO_3}=\dfrac{0,1.126}{172}.100\%\approx7,33\%\\C\%_{K_2SO_3}=\dfrac{0,2.158}{172}.100\%\approx18,37\%\end{matrix}\right.\)
c, \(n_{Ba\left(OH\right)_2}=0,5.1=0,5\left(mol\right)\)
\(\Rightarrow\dfrac{n_{SO_2}}{n_{Ba\left(OH\right)_2}}=0,6< 1\) → Pư tạo BaSO3.
PT: \(SO_2+Ba\left(OH\right)_2\rightarrow BaSO_3+H_2O\)
\(n_{BaSO_3}=n_{SO_2}=0,3\left(mol\right)\Rightarrow m_{BaSO_3}=0,3.217=65,1\left(g\right)\)

a) n Fe = a(mol) ; n Cu = b(mol)
=> 56a + 64b = 4,8(1)
n SO2 = 2,24/22,4 = 0,1(mol)
Bảo toàn e :
3n Fe + 2n Cu = 2n SO2
<=> 3a + 2b = 0,2(2)
Từ (1)(2) suy ra a = b = 0,04
%m Fe = 0,04.56/4,8 .100% = 46,67%
%m Cu = 100% -46,67% = 53,33%
b)
n KOH = 0,15
Ta có :
1 < n KOH / n SO2 = 0,15/0,1 = 1,5 < 2 nên muối sinh ra là Na2SO3(x mol) và NaHSO3(y mol)
2NaOH + SO2 $\to$ Na2SO3 + H2O
NaOH + SO2 $\to$ NaHSO3
Theo PTHH :
n SO2 = a + b = 0,1
n NaOH = 2a + b = 0,15
Suy ra a= 0,05 ; b = 0,05
m muối = 0,05.126 + 0,05.104 = 11,5 gam
Bài 2 :
- Gọi số mol Fe và Cu lần lượt là a, b mol
Ta có : mhh = mFe + mCu = 56a + 64b = 4,8
Bte : 3a + 2b = 0,2
=> a = b =0,04mol
a, Ta có : mFe =n.M = 2,24g ( 46,7% )
=> %Cu = 53,3%
b, Ta thấy sau phản ứng thu được K+, SO3-2 xmol, HSO3- y mol
BtS : x + y = 0,1
BTĐT : 2x + y = 0,15
=> x =y = 0,05 mol
=> mM = mK2SO3 + mKHSO3 = 13,9g

\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ n_{ZnCl_2}=n_{Zn}=n_{H_2}=0,15\left(mol\right);n_{HCl}=2.0,15=0,3\left(mol\right)\\ a,m=m_{Zn}=0,15.65=9,75\left(g\right)\\ b,C_{MddHCl}=\dfrac{0,3}{0,15}=0,2\left(l\right)\\ c,m_{ZnCl_2}=0,15.136=20,4\left(g\right)\)

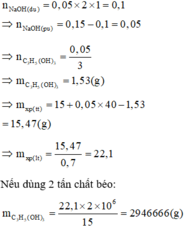
\(n_{Zn\left(OH\right)_2\left(mp\right)}=\dfrac{19.8}{99\cdot2}=0.1\left(mol\right)\)
\(a.\)
\(n_{H_2SO_4}=0.15\left(mol\right)\)
\(Zn\left(OH\right)_2+H_2SO_4\rightarrow ZnSO_4+2H_2O\)
Lập tỉ lệ :
\(\dfrac{0.1}{1}< \dfrac{0.15}{1}\) \(\Rightarrow H_2SO_4dư\)
\(m_{ZnSO_4}=0.1\cdot161=16.1\left(g\right)\)
\(b.\)
\(n_{NaOH}=0.15\left(mol\right)\)
\(2NaOH+Zn\left(OH\right)_2\rightarrow Na_2ZnO_2+2H_2O\)
Lập tỉ lệ :
\(\dfrac{0.15}{2}< \dfrac{0.1}{1}\Rightarrow Zn\left(OH\right)_2dư\)
\(n_{Na_2ZnO_2}=\dfrac{1}{2}n_{NaOH}=\dfrac{1}{2}\cdot0.15=0.075\left(mol\right)\)
\(m=0.075\cdot143=10.725\left(g\right)\)