lấy 12.5 g CuSO4.xH2O đun nóng để làm mất nước thì thu được muối khan có khối lượng nhẹ hơn khối lượng ban đầu là 4,5 g. xác định ct của muối ngậm nước
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Tóm tắt:
\(m_1=840g=0,84kg\)
\(t_1=120^oC\)
\(V=2l\Rightarrow m_2=2kg\)
\(t=40^oC\)
\(c_1=380J/kg.K\)
\(c_2=4200J/kg.K\)
========
\(t_2=?^oC\)
Nhiệt độ ban đầu của nước :
Thep pt cân bằng nhiệt:
\(Q_1=Q_2\)
\(\Leftrightarrow m_1.c_1.\left(t_1-t\right)=m_2.c_2.\left(t-t_2\right)\)
\(\Leftrightarrow0,84.380.\left(120-40\right)=2.4200.\left(40-t_2\right)\)
\(\Leftrightarrow t_2=36,96^oC\)
Tóm tắt
\(m_1=840g=0,84kg\\ t_1=120^0C\\ V=2l\Rightarrow m_2=2kg\\ t=40^0C\\ c_1=380J/kg.K\\ c_2=4200J/kg.K\)
______________
\(t_2=?^0C\)
Giải
Theo phương trình cân bằng nhiệt ta có:
\(Q_1=Q_2\\ \Leftrightarrow m_1.c_1.\left(t_1-t\right)=m_2.c_2.\left(t-t_2\right)\\ \Leftrightarrow0,84.380.\left(120-40\right)=2.4200.\left(40-t_2\right)\\ \Leftrightarrow t_2=37^0C\)

mCaSO4=19,11-4=15,11g
=>nCaSO4=15,11/136(mol)
nH2O=4/18 (mol)
Công thức là CaSO4:nH2O
=>1:n=nCaSO4:nH2O=1:2
=> CaSO4.2H2O

Gọi a, b lần lượt là số mol của NaI và NaBr ban đầu, ta có : Sơ đồ phản ứng:
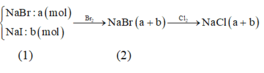

Đáp án A
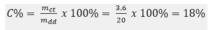
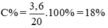
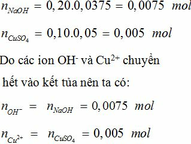

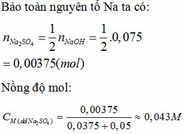
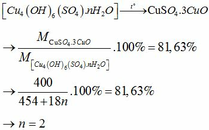

Ta có:mCuSO4=12,5-4,5=8(g)\(\Rightarrow\)nCuSO4=\(\frac{8}{160}\)=0,05(mol)
Mà nCuSO4=nCuSO4.xH2O=0,05(mol)
\(\Rightarrow\)0,05.(160+18x)=12,5\(\Rightarrow\)160+18x=250\(\Rightarrow\)18x=90\(\Rightarrow\)x=5
Vậy CTHH của muối ngậm nước là:CuSO4.5H2O