Ngâm 45,5 hỗn hợp bột các kim loại : Zn,Cu,Ag trong dung dịch HCl dư thu được 4,48l khí (đktc). Nếu nung 1 lượng hỗn hợp như trên trong không khí , phản ứng xog thu được hỗn hợp rắn mới có khối lượng là 51,9 g. XĐ khối lượng của mỗi kim loại trong hỗn hợp ban đầu ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Khi cho tác dụng với HCl thì chỉ có Zn phản ứng
Zn + 2HCl ----> ZnCl2 + H2 (1)
0.2mol <------------------------- 0.2mol
Vậy khối lượng Zn = 13g
Nung hh trên trong không khí sẽ có các phản ứng:
Zn + O2 ----> ZnO (2)
0.2mol -----------------> 0.2mol = 16.2g
Cu + 1/2O2 ----> CuO
Ta nhận thấy Ag không phản ứng với Ôxi vậy khối lượng chất rắn tăng lên là do sự hình thành 2 ôxit ZnO và CuO. Số mol của O trong hổn hợp 2 ôxit = (51.9 - 45.5) / 16 = 0.4 mol
Theo PT (2) ta thấy số mol của O trong ZnO =số mol của ZnO = 0.2 mol, vậy số mol của O trong CuO = 0.4 - 0.2 = 0.2 mol. Số mol của Cu = 0.2 mol -> khối lượng Cu ban đầu = 0.2 * 64 = 12.8g
Khối lượng Ag trong hh ban đầu = 45.5 - 12.8 - 13 = 19.7g.
Vì Cu và Ag là 2 kim loại đứng sau H2 trong dãy hoạt động của kim loại nên ko thể tác dụng được với dd HCl
Theo đề bài ta có : nH2 = \(\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
a) PTHH :
\(Zn+2HCl->ZnCl2+H2\uparrow\)
0,2mol.....................................0,2mol
\(2Cu+O2-^{t0}->2CuO\)
\(2Zn+O2-^{t0}->2ZnO\)
0,2mol........................0,2mol
\(Ag+O2\ne ko-p\text{ư}\)
Chất rắn thu được sau khi nung là CuO và ZnO , Ag
Gọi x,y lần lượt là số mol của Cu và Ag
Ta có :
mZnO + mCuO + mAg = 51,9
mZn + mCu + mAg = 45,5
ta có :
mCu + mAg = 45,5 - 0,2.65
<=> 64x + 108y =32,5 (1)
mCuO + mAg = 51,9 - 0,2.81
<=> 80x + 108y = 35,7 (2)
Giải (1) và (2) ta được : \(\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,182\left(mol\right)\end{matrix}\right.\)
b)
thành phần % theo khối lượng có trong hỗn hợp ban đầu là :
\(\left\{{}\begin{matrix}\%mZn=\dfrac{0,2.65}{45,5}.100\%\approx28,57\%\\\%mCu=\dfrac{0,2.64}{45,5}.100\%\approx28,13\%\\\%mAg=100\%-28,57\%-28,13\%=43,3\%\end{matrix}\right.\)
Vậy...

a) Gọi số mol Zn, Cu, Ag là a, b, c
=> 65a + 64b + 108c = 45,5 (1)
Phần rắn không tan gồm Cu, Ag
=> 64b + 108c = 32,5 (2)
(1)(2) => a = 0,2 (mol)
\(n_{O_2}=\dfrac{51,9-45,5}{32}=0,2\left(mol\right)\)
PTHH: 2Zn + O2 --to--> 2ZnO
0,2---->0,1
2Cu + O2 --to--> 2CuO
b---->0,5b
=> 0,1 + 0,5b = 0,2
=> b = 0,2
\(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,2.65}{45,5}.100\%=28,57\%\\\%m_{Cu}=\dfrac{0,2.64}{45,5}.100\%=28,13\%\\\%m_{Ag}=\dfrac{45,5-0,2.65-0,2.64}{45,5}.100\%=43,3\%\end{matrix}\right.\)
b)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,2-->0,4
=> mHCl = 0,4.36,5 = 14,6 (g)
=> \(m_{ddHCl}=\dfrac{14,6.100}{10}=146\left(g\right)\)

Đặt nZn = x mol; nFe = y mol.
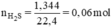
Ta có hệ phương trình: 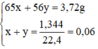
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

phương trình bn tự ghi nha:
đặt số mol 3 KL Zn, Fe, Cu lần lượt là a, b, c (mol), ta có pt theo đề bài:
65a+56b+64c=21.6 (1)
c=3/64 (2)
a+b=6.72/22.4 (3)
Từ (1)(2)(3)==> a=0.2(mol), b=0.1(mol), c=3/64(mol)
==>%Zn=0.2x65x100/21.6=60.185%
%Fe=0.1x56x100/21.6=25.925%
%Cu=100%-(60.185%+25.925%)=13.89%

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl -->ZnCl2 + H2
____0,2<----------------------0,2
=> mZn = 0,2.65 = 13 (g)
mCu = mrắn không tan = 19,5 (g)
\(\left\{{}\begin{matrix}\%Zn=\dfrac{13}{13+19,5}.100\%=40\%\\\%Cu=\dfrac{19,5}{13+19,5}.100\%=60\%\end{matrix}\right.\)
`n_(H_2)=4,48/22,4=0,2 (mol)`
Ta có PTHH: `Zn+2HCl --> ZnCl_2 +H_2`
Theo PT: `1`--------------------------------`1`
Theo đề: `0,2`------------------------------`0,2`
`m_(Zn)=0,2.65=13(g)`
Vì `Cu` không phản ứng với `HCl` nên `m_(chất rắn không tan)=m_(Cu)=19,5(gam)`
`%Zn=13/(13+19,5) .100%=40%`
`%Cu=100%-40%=60%`

a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT: \(n_{Zn}=n_{H_2}=0,2\left(mol\right)\Rightarrow m_{Zn}=0,2.65=13\left(g\right)\)
\(\Rightarrow m_{Ag}=20-13=7\left(g\right)\)
b, \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{13}{20}.100\%=65\%\\\%m_{Ag}=100-65=35\%\end{matrix}\right.\)

a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Ta có: \(n_{Zn}=n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(\Rightarrow m_{Zn}=0,2.65=13\left(g\right)\)
Bạn xem lại xem đề cho bao nhiêu gam hỗn hợp nhé, vì mZn đã bằng 13 (g) rồi.
n\(_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2 0,2 (mol)
\(\rightarrow m_{Zn}=0,2.65=13\left(g\right)\)
\(\Rightarrow m_{Cu,Ag}=45,5-13=32,5\left(g\right)\)
đặt số mol của Cu là a;Ag là b,ta có:
64a+108b=32,5(1)
\(Zn+\dfrac{1}{2}O_2\rightarrow ZnO\)
0,2 0,2 (mol)
\(\rightarrow m_{ZnO}=0,2.81=16,2\left(g\right)\)
\(\rightarrow m_{CuO,Ag_2O}=\)51,9-16,2=35,7(g)
\(Cu+\dfrac{1}{2}O_2\rightarrow CuO\)
a a (mol)
\(2Ag+\dfrac{1}{2}O_2\rightarrow Ag_2O\)
b \(\dfrac{1}{2}b\) (mol)
ta có:\(80a+116b=35,7\)(2)
từ (1) và (2) ta có hệ:
\(\Leftrightarrow\left\{{}\begin{matrix}64a+108b=32,5\\80a+116b=35,7\end{matrix}\right.\)\(\Leftrightarrow\left\{{}\begin{matrix}a=\dfrac{107}{1520}\\b=\dfrac{197}{760}\end{matrix}\right.\)
\(\rightarrow m_{Cu}=\dfrac{107}{1520}.64\approx4,5\left(g\right)\)
\(m_{Ag}=\dfrac{197}{760}.108\approx28\left(g\right)\)