Khi hoà tan 1 lượng hỗn hợp gồm Fe và FeO bằng đung dịch H2SO4 loãng vừa đủ thu được dung dịch X trong đó số nguyên tử H2 =48/25 số nguyên tử O2. Viết PTHH và tính nồng độ phần trăm chất tan có trong dd X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Fe + H2SO4 -> FeSO4 + H2
FeO + H2SO4 -> FeSO4 + H2O
H2 là khí nên sẽ không có trong dung dịch X
=> Dung dịch X gồm muối và nước là FeSO4 và H2O
Gọi số mol H2O là x mol; mol FeSO4 là y mol
=> nH2 = 2x ; nO = x + 4y(1)
Ta có nH2:nO2 = 48/25
Thay (1) vào ta được 2x/x+4y=48/25
<=> 50x = 48x +192y
<=> 2x = 192y
<=> x = 96y
mFeSO4 = (56+32+16.4).y = 152y
C%FeSO4 = m/mdd.100
= 152y/152y +18x.100 =152y/152y + 1728y.100 = 8,085%

a,Fe + 2HCl → FeCl + H2 (1)
FeO + 2HCl → FeCl + H2O (2)
nH2 = 3,36/ 22,4 = 0,15 ( mol)
Theo (1) nH2 = nFe = 0,15 ( mol)
mFe = 0,15 x 56 = 8.4 (g)
m FeO = 12 - 8,4 = 3,6 (g)
a, \(n_{H_2}=\frac{3,36}{22,4}=0,15\left(mol\right)\)
\(Fe+2HCl->FeCl_2+H_2\left(1\right)\)
\(FeO+2HCl->FeCl_2+H_2O\left(2\right)\)
theo (1) \(n_{Fe}=n_{H_2}=0,15\left(mol\right)\)
=> \(m_{Fe}=0,15.56=8,4\left(g\right)\)
=> \(m_{FeO}=12-8,4=3,6\left(g\right)\)

ta thấy : nFe =nH2 = 0,15
=> mFe =0,15 x 56 = 8,4g
%Fe=8,4/12 x 100 = 70%
=>%FeO = 100 - 70 = 30%
b) BTKLra mdd tìm mct of HCl
c) tìm mdd sau pứ -mH2 nha bạn

nH2 = 2.24/22.4 = 0.1 (mol)
Fe + 2HCl => FeCl2 + H2
0.1___0.2_____0.1___0.1
mFeO = 12.8 - 0.1*56 = 7.2 (g)
nFeO = 7.2/72 = 0.1 (mol)
FeO + 2HCl => FeCl2 + H2O
0.1____0.2______0.1
%Fe = 5.6/12.8 * 100% = 43.75%
%FeO = 56.25%
nHCl = 0.2 + 0.2 = 0.4 (mol)
Vdd HCl = 0.4/0.1 = 4(l)
nFeCl2 = 0.1 + 0.1 = 0.2 (mol)
CM FeCl2 = 0.2/4 = 0.05 (M)

a,Giả sử mddHCl = 36,5 (g) \(\Rightarrow n_{HCl}=\dfrac{36,5.0,2}{36,5}=0,2\left(mol\right)\)
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: a 2a a a
PTHH: Mg + 2HCl → MgCl2 + H2
Mol: b 2b b b
Ta có: \(2a+2b=0,2\Leftrightarrow a+b=0,1\left(mol\right)\)
mdd D = 56a+24b+36,5-(a+b).2 = 56a+24b+36,3 (g)
\(C\%_{ddFeCl_2}=\dfrac{127a.100\%}{56a+24b+36,3}=15,757\%\)
\(\Leftrightarrow127a=8,82392a+3,78168b+5,719791\)
\(\Leftrightarrow118,17608a-3,78168b=5,719791\)
Ta có: \(\left\{{}\begin{matrix}a+b=0,1\\118,17608a-3,78168b=5,719791\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,05\\b=0,05\end{matrix}\right.\)
\(C\%_{ddMgCl_2}=\dfrac{95.0,05.100\%}{56.0,05+24.0,05+36,3}=11,79\%\)

Đáp án C
Chọn số mol Mg trong hỗn hợp ban đầu là 1. Khi đó gọi số mol Zn ban đầu là x.
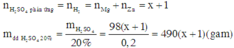
Theo định luật bảo toàn khối lượng ta có:
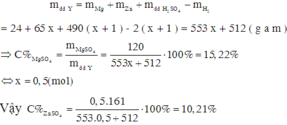

Đáp án B
Fe+2HCl → FeCl2 + H2
a 2a a a
Mg + 2HCl → MgCl2+H2
b 2b b b
mchất rắn X = 56a + 24b ; mddHCl = 36,5/20% .2.(a + b) = 365(a + b)
![]()
⇒ mddsau pư = 56a + 24b + 365(a + b) – 2(a + b) = 419a + 387b
![]() .100 = 15,76
.100 = 15,76
Giải PT ⇒ a = b ⇒ ![]() .100 = 11,79%
.100 = 11,79%
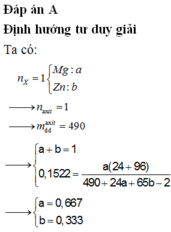
PTHH
Fe + H2SO4--> FeSO4 + H2
FeO + H2SO4 --> FeSO4 + H2O
Đặt nH2O( X ) = x mol
nFeSO4( X ) = y mol
Ta có
nH = 2x mol ; nO = x + 4y mol
Theo đề bài
\(\frac{2x}{x+4y}=\frac{48}{25}\) => x = 96y
=>C%( FeSO4) =\(\frac{152y}{152y+18x}\cdot100\%=8.085\%\)
Anh ơi cho em hỏi là tổng mol O là 4x+5y ms đúng chứ nó gồm mol O của feso4 2 phương trình và h2o và C% là phải có nc của dd h2so4, muối và nc phản ứng đc mà sao ở bài làm nó chỉ có muối vs nc phản ứng v ạ mong anh rep em sớm và giải thích chi tiết cho em, em cảm ơn