Đốt 33.6 gam Fe trong 11.2 lít (đktc ) khí Ỗi thu được Fe3O4. Tính khối lượng mỗi chất thu được sau phản ứng biết hiệu suất là 80%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\\ n_{O_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\\ PTHH:4P+5O_2\underrightarrow{t^o}2P_2O_5\\ LTL:\dfrac{0,2}{4}< \dfrac{0,4}{5}\Rightarrow O_2dư\)
\(n_{O_2\left(pư\right)}=\dfrac{5}{4}n_P=\dfrac{5}{4}.0,2=0,25\left(mol\right)\\ n_{O_2\left(dư\right)}=0,4-0,25=0,15\left(mol\right)\)
\(n_{P_2O_5\left(lt\right)}=\dfrac{1}{2}n_P=\dfrac{1}{2}.0,2=0,1\left(mol\right)\\ m_{P_2O_5\left(lt\right)}=0,1.142=14,2\left(g\right)\\ m_{P_2O_5\left(tt\right)}=0,1.142.80\%=11,36\left(g\right)\)

Đầu tiên phải đổi về số mol đã:
PTHH: 2 KMnO4
K2MnO4 + MnO2 + O2
pt 2 1 1 1
Mol 0,9 0,45 0,45 0,45
Hp/ứ = 80% m KMnO4 ban đầu =
nKMnO4 ban đầu = 177,75: 158 = 1,125 mol
nKMnO4 dư= 1,125 – 0,9 = 0,225 mol.
Thuốc tím có lẫn 10% tạp chất
m thuốc tím =
Khối lượng chất rắn sau phản ứng: 197,5 – 0,45.32 = 183,1 gam
Chất rắn sau phản ứng gồm KMnO4 dư, K2MnO4, MnO2, tạp chất.
%MnO2/CR=
%K2MnO4/CR=
\(n_K=n_{O_2}=\dfrac{V}{22,4}=0,45\left(mol\right)\)
\(PTHH:2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2\)
....................0,9..............................................0,45........
\(\Rightarrow m_{KMnO_4}=n.M=142,2\left(g\right)\)
Mà H = 80 %
\(\Rightarrow m_{KMnO_4tg}=177,75\%\)
Lại có : Trong m g thuốc tím chỉ có 90% phản ứng .
\(\Rightarrow m=197,5\left(g\right)\)
Vậy ...

\(n_{Fe}=\dfrac{12.6}{56}=0.225\left(mol\right)\)
\(n_{O_2}=\dfrac{4.2}{22.4}=0.1875\left(mol\right)\)
\(3Fe+2O_2\underrightarrow{^{^{t^0}}}Fe_3O_4\)
\(3.........2\)
\(0.225......0.1875\)
Lập tỉ lệ : \(\dfrac{0.225}{3}< \dfrac{0.1875}{2}\Rightarrow O_2dư\)
\(m_{O_2\left(dư\right)}=\left(0.1875-0.225\cdot\dfrac{2}{3}\right)\cdot32=1.2\left(g\right)\)
\(m_{Fe_3O_4}=\dfrac{0.225}{3}\cdot232=17.4\left(g\right)\)

a)
Theo ĐLBTKL: \(m_{Fe\left(bđ\right)}+m_{O_2}=m_X\)
=> \(m_{O_2}=26,4-20=6,4\left(g\right)\)
=> \(n_{O_2}=\dfrac{6,4}{32}=0,2\left(mol\right)\Rightarrow V=0,2.22,4=4,48\left(l\right)\)
b)
PTHH: 3Fe + 2O2 --to--> Fe3O4
0,2------->0,1
=> \(\%m_{Fe_3O_4}=\dfrac{0,1.232}{26,4}.100\%=87,88\%\)
c)
- Nếu dùng KClO3
PTHH: 2KClO3 --to--> 2KCl + 3O2
\(\dfrac{0,4}{3}\)<-----------------0,2
=> \(m_{KClO_3}=\dfrac{0,4}{3}.122,5=\dfrac{49}{3}\left(g\right)\)
- Nếu dùng KMnO4:
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
0,4<--------------------------------0,2
=> \(m_{KMnO_4}=0,4.158=63,2\left(g\right)\)

PT: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
Ta có: \(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
\(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,3}{3}< \dfrac{0,3}{2}\) , ta được O2 dư.
Mà: H% = 80% \(\Rightarrow n_{Fe\left(pư\right)}=0,3.80\%=0,24\left(mol\right)\)
\(\Rightarrow n_{Fe\left(dư\right)}=0,3.0,24=0,06\left(mol\right)\)
Theo PT: \(n_{Fe_3O_4}=\dfrac{1}{3}n_{Fe}=0,1\left(mol\right)\)
Chất rắn thu được gồm Fe dư và Fe3O4.
⇒ mcr = mFe (dư) + mFe3O4 = 0,06.56 + 0,1.232 = 26,56 (g)
Bạn tham khảo nhé!

4Al+3O2-to>2Al2O3
0,15-------0,1 mol
n Al=\(\dfrac{10,8}{27}\)=0,4 mol
n O2=\(\dfrac{3,36}{22,4}\)=0,15 mol
=>Al dư ,
H=90%
=>m Al2O3=0,1.102.\(\dfrac{90}{100}\)=9,18g
nAl = 10,8/27 = 0,4 (mol)
nO2 = 3,36/22,4 = 0,15 (mol)
PTHH: 4Al + 3O2 -> (t°) 2Al2O3
LTL: 0,4/4 < 0,15/3 => Al dư
nAl2O3 (LT) = 0,15 : 3 . 2 = 0,1 (mol)
nAl2O3 (TT) = 0,1 . 90% = 0,09 (mol)
mAl2O3 (TT) = 0,09 . 102 = 9,18 (g)

Đáp án D
8 Al + 3 Fe 3 O 4 → t o 4 Al 2 O 3 + 9 Fe
Khối lượng nhôm giảm chính là khối lượng nhôm đã tham gia phản ứng.
⇒ n Al phan ung = 0 , 81 27 = 0 , 03 ⇒ n Fe 3 O 4 = 3 8 n Al phan ung = 0 , 01125
Vì A tác dụng với dung dịch NaOH có H2 nên A có chứa Al dư và
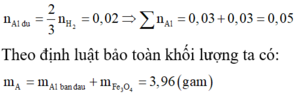

Theo gt ta có: $n_{Fe_3O_4}=0,05(mol)$
$Fe_3O_4+4H_2\rightarrow 3Fe+4H_2O$
Ta có: $n_{H_2}=0,05.4=0,2(mol)\Rightarrow V_{H_2}=4,48(l)$
Khí oxi nhá
số mol oxi: 11,2 : 22,4 = 0,5 (mol)
PTHH: 3Fe+2O2->Fe3O4
số mol fe: 33,6:56=0,6 mol
-> O2 dư
mfe3o4= 0,2.(56.3+16.4)=46,4(g)
mo2 dư= 0,05.16.2=1,6 g