Hòa tan 49.6g hỗn hợp A gồm Fe, FeO, Fe3O4, Fe2O3 bằng dung dịch H2SO4 đặc nóng (PƯ hoàn toàn) thu được dung dịch B và 8.96l SO2(đktc)?
a) tính %mo2 trong hỗn hợp X b) Tính m muối trong dung dịch YHãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


*Sửa đề: Tính %m của Oxi
Với bài này thì ko cần viết phương trình đâu bạn nhé :))
Coi hỗn hợp A gồm Fe (a mol) và O (b mol) \(\Rightarrow56a+16b=49,6\) (1)
Ta có: \(n_{SO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Bảo toàn electron: \(3n_{Fe}=2n_O+2n_{SO_2}\) \(\Rightarrow3a-2b=0,8\) (2)
Từ (1) và (2) \(\Rightarrow\) \(\left\{{}\begin{matrix}a=0,7\\b=0,65\end{matrix}\right.\) \(\Rightarrow\%m_O=\dfrac{0,65\cdot16}{49,6}\cdot100\%\approx20,97\%\)

a) \(2Fe+6H_2SO_4\text{đặc}\rightarrow^{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
\(2FeO+4H_2SO_4\text{đặc}\rightarrow^{t^0}Fe_2\left(SO_4\right)_3+SO_2+4H_2O\)
\(2Fe_3O_4+10H_2SO_4\text{đặc}\rightarrow3Fe_2\left(SO_4\right)_3+SO_2+10H_2O\)
Quy đổi hỗn hợp A gồm x mol Fe và y mol O
\(\Rightarrow56x+16y=49,6\) (1)
\(Fe\rightarrow Fe^{3+}+3e\)
x ------------> 3x
\(S^{+6}+2e\rightarrow S^{+4}\)
..........0,8 <--- 0,4
\(O+2e\rightarrow O^{2-}\)
y --> 2y
\(\Rightarrow3x=2y+0,8\) (2)
Giải hệ (1)(2) được x = 0,7 mol, y = 0,65 mol
\(\Rightarrow\%m_O=\dfrac{16.0,65}{49,6}.100\%=20,97\%\)
Ta có:
\(2H_2SO_4+2e\rightarrow SO_4^{2-}+SO_2\uparrow+2H_2O\)
...............................0,4 <---- 0,4
\(\Rightarrow n_{SO_4^{2-}}\text{tạo muối với cation kim loại}=0,4\) mol
\(\Rightarrow m_{\text{muối}}=m_{\text{kim loại}}+m_{SO_4^{2-}}\text{tạo muối với cation kim loại}\)
\(=56.0,7+96.0,4=77,6\) gam

Coi X gồm Fe và O.
Ta có: 56nFe + 16nO = 49,6 (1)
\(n_{SO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
BT e, có: 3nFe - 2nO = 2nSO2 = 0,8 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,7\left(mol\right)\\n_O=0,65\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\%m_O=\dfrac{0,65.16}{49,6}.100\%\approx20,97\%\)
Muối thu được là Fe2(SO4)3
BTNT Fe, có: \(n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Fe}=0,35\left(mol\right)\)
\(\Rightarrow m_{Fe_2\left(SO_4\right)_3}=0,35.400=140\left(g\right)\)

Quy đổi hỗn hợp X thành Fe (a mol) và O (b mol)
Các quá trình nhường và nhận electron:
Theo định luật bảo toàn khối lượng ta có: 56a + 16b = 49,6 (1)
Theo định luật bảo toàn electron ta có: 0,4.2 + 2b = 3a (2)
(1) và (2) => a = 0,7; b = 0,65 (mol)
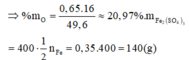
Đáp án A


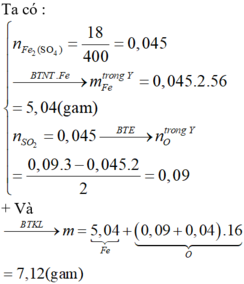
Quy đổi hh X thành Fe và Fe2O3
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O (1)
0.2 mol 0.3 mol
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O (2)
nSO2 = 6.72 / 22.4 = 0.3 (mol)
Theo pthh (1) nFe = 2/3 nSO2 = 2/3 . 0.3 = 0.2 mol
=>mFe = 0.2 X 56 = 11.2 (g)
=>mFe2O3 = 49.6 - 11.2=38.4 (g)
=>nFe2O3 = 38.4 / 160 = 0.24 mol
=> nO (trong Fe2O3) = 3 X nFe2O3 = 3 X 0.24 =0.72 (mol)
(vì n(nguyên tố ) = n(chất) X hệ số nguyên tố nên ta có nO = nFe2O3 X hệ số 3 của O )
%mO (hh X ) = (0.72 X 16 X 100)/49.6 = 23.23 %
49.6g hỗn hợp X nhé bạn