Bài 1:
Một bình cầu dung tích 448 ml được nạp đầy oxi rồi cân. Phóng điện để ozon hóa, sau đó nạp thêm cho đầy khí oxi rồi cân. Khối lượng trong hai trường hợp chênh lệch nhau 0,03 gam. Biết các thể tích nạp đều ở đktc. Thành phần % về thể tích của ozon trong hỗn hợp sau phản ứng là bao nhiêu?
Bài 2:
Cho 1,26 gan một kim loại tác dụng với dung dịch H2SO4 loãng tạo ra 3,42 gam muối sunfat. Hãy xác định tên kim loại?


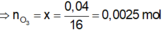
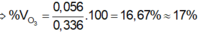

M + H2SO4\(\rightarrow\)muối + H2
---------x---------------->x
Bảo toàn khối lượng ta có:
1,26 + 98x = 3,42 + 2x
=>x=0,0225 mol
=>M=1,26/0,0225=56 (Fe)
1.nO2(bđ)= \(\dfrac{0,448}{22,4}\)= 0,02 mol
ta có
O2 + [O] \(\rightarrow\)O3
sau khi nạp đầy thì khối lượng sau > khối lượng trước 0,06 (g)
đó chính là khối lượng [O] từ O2\(\rightarrow\) O3
\(\Rightarrow\) n[O] = 0,06/16 = 0,00375 mol
O2 + [O] \(\rightarrow\)O3
......0,00375...........0,00375
\(\Rightarrow\) mO3 = 0,00375.48 = 0,18 (g)
%m O3=\(\dfrac{0,18}{0,7}.100\%=25,7\%\)