Cho 200 ml dung dịch E gồm AlCl3 x mol/lít và Al2(SO4)3 y mol/lít tác dụng với 700 ml dung dịch NaOH 1M, sau khi các phản ứng kết thúc thu được 7,8 gam kết tủa. Mặt khác, khi cho 200 ml E tác dụng với dung dịch BaCl2 (dư) thì thu được 27,96 gam kết tủa. Tính x,y?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


400 ml dd E gồm AlCl3 xM và Al2(SO4)3 yM + 0,612 mol NaOH → 0,108 mol Al(OH)3.
400 ml E + BaCl2 dư → 0,144 mol ↓BaSO4.
=> n BaSO4 = 3y = 0,144 → y = 0,048 (*).
Ở TN1:
nAl(OH)3 = nAl3+ - (nOH- - 3nAl3+)
= 4nAl3+ - nOH-
= 4(x + 2y) - 0,612 = 0,108 (**)
Từ (*), (**) => x = 0,084.

Đáp án C
Trong 400 ml dung dịch E có :
![]()
![]()
![]()
⇔ n OH - ban đầu > n OH - / Al OH 3
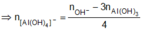
= 0,072 mol
Vậy trong phản ứng của E với dung dịch NaOH đã có hiện tượng hòa tan một phần kết tủa.
Áp dụng bảo toàn điện tích trong dung dịch G, ta có :
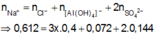
![]()
Suy ra : x:y = 0,21:0,12 = 7:4

Đáp án C


● Nhận xét: Khi gặp dạng bài này ta nên xét trường hợp dễ xảy ra nhất, đó là Al(OH)3 bị tan một phần.
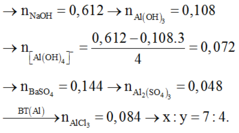


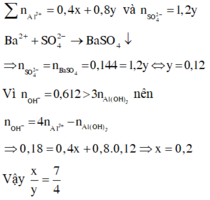
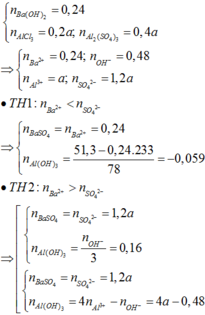



Trong 200 ml dung dịch E:
\(n_{Al^{3+}}=n_{AlCl_3}+2n_{Al_2\left(SO_4\right)_3}=0,2x+0,4y\) (mol)
\(n_{OH^-}=n_{NaOH}=0,7mol\)
+ E + NaOH: \(n_{Al\left(OH\right)_3}=\dfrac{7,8}{78}=0,1mol\)
\(Al^{3+}+3OH^-\rightarrow Al\left(OH\right)_3\downarrow\)
0,1<-----0,3<----------0,1
\(Al^{3+}+4OH^-\rightarrow\left[Al\left(OH\right)_4\right]^-\)
0,1<-----------0,4
\(\Rightarrow n_{Al^{3+}}=0,1+0,1=0,2mol\) \(\Rightarrow0,2x+0,4y=0,2\) (1)
+ E + BaCl2 dư: \(n_{BaSO_4}=\dfrac{27,96}{233}=0,12mol\)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\downarrow\)
.............0,12<------0,12
\(\Rightarrow n_{SO_4^{2-}}=3n_{Al_2\left(SO_4\right)_3}=3.0,2.y=0,12\)
\(\Rightarrow y=0,2\text{mol/lít}\) , thay vào (1) được \(x=0,6\text{mol/lít}\)