Cho 14 gam hỗn hợp A gồm: Ag , Al ,Cu vào dung dịch H 2 SO 4 loãng (dư).Sau
phản ứng thu được chất rắn B, dung dịch D và 8,064 lít khí H 2 ( điều kiện tiêu chuẩn).
a.Viết phương trình phản ứng xảy ra ?
b.Tính khối lượng các kim loại trong hỗn hợp A ? Biết rằng m Cu gấp ba lần m Ag .
c.Tính khối lượng dung dịch H 2 SO 4 24,5% đã dùng? Biết rằng người ta dùng dư 15%
d. Tính nồng độ phần trăm của các chất tan trong dung dịch thu được sau phản ứng ?

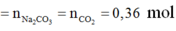
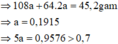
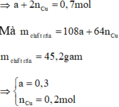


a/ Chỉ có Al tan , Ag và Cu không t/d
PTHH :2Al + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2
mol :0,24....0,36...........0,12.............0,36
b/ Có : nH2 = 8,064/22,4 = 0,36(mol)
mAl = 0,24 . 27 =6,48(g)
=> m(Cu + Ag) = 14 - 6,48 = 7,52(g)
Đặt mAg = a (g) => mCu = 3a(g)
=> a + 3a = 7,52
=> a = 1,88(g)
Do đó : \(\left\{{}\begin{matrix}m_{Al}=6,48\left(g\right)\\m_{Ag}=a=1,88\left(g\right)\\m_{Cu}=3a=3.1,88=5,64\left(g\right)\end{matrix}\right.\)
c/ mH2SO4 (Pứ) = 0,36 . 98 =35,28(g)
=> mdd H2SO4 (Pứ)= \(\dfrac{35,28.100\%}{24,5\%}=144\left(g\right)\)
mà cần dùng dư 15 % so với lý thuyết
=> mdd H2SO4 (cần dùng) = 144 + 15%. 144 =165,6(g)
d/ Vì t/d với dd H2SO4 loãng dư
=> dd D gồm \(\left\{{}\begin{matrix}H_2SO_4dư\\Al_2\left(SO_4\right)_3\end{matrix}\right.\)
Theo ĐLBTKL :
mdd sau pứ = mAl + mdd H2SO4 - mH2 = 6,48 + 165,6 - 0,36.2 =171,36(g)
=> C%Al2(SO4)3 / dd D = \(\dfrac{0,12.342}{171,36}.100\%=23,95\%\)
Do dùng dư 15% so với lý thyết
=> mH2SO4 (dư ) = 15% . 35,28 =5,292(g)
=> C%H2SO4 / dd D = \(\dfrac{5,292}{171,36}.100\%=3,1\%\)
\(n_{H2} = \dfrac{8,064}{22,4} = 0,36 (mol)\)
( \(H_{2}SO_{4}\) loãng nên Ag, Cu không tác dụng được )
Pt : \(2Al + 3H_{2}SO_{4} \rightarrow Al_{2}(SO_{4}) _{3} + 3H_{2}\)
2 mol 3 mol 3 mol
0,24 mol<--- 0,36 mol <--- 0,36 mol
\(\Rightarrow m_{Al} = 0,24 .27 =6,48 (g)\)
Theo gt: \(m_{Cu} = 3m_{Ag}\)
\(\Rightarrow m_{Ag} + m_{Cu} + m_{Al} = 14\)
\(\Leftrightarrow m_{Ag} + 3m_{Ag} + 6,48 = 14\)
\(\Leftrightarrow 4m_{Ag} = 7,52 \)
\(\Leftrightarrow m_{Ag} = 1,88 (g)\)
\(\Rightarrow m_{Cu} = 3m_{Ag} = 3.1,88 =5,64 (g)\)
\(m_{H_{2}SO_{4}} = \dfrac{0,36.98.100}{24,5} = 144(g)\) (1 )
Vì dùng dư 15% => 100 + 15 = 1,15 (2)
(1)(2) => \(m_{{dd}_{H_{2}SO_{4}}} = 144.1,15 = 165,6 (g)\)
\(m_{dd\left(spu\right)}=m_{Al}+m_{H_2SO_4}-m_{H_2}\)
= 6,48 + 165,6 - 0,36.2
= 171,36 (g)
\(C\%_{Al_2\left(SO_4\right)_3}=\dfrac{0,36.342.100}{171,36}=20,58\%\)