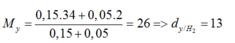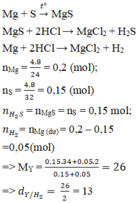đun nóng hỗn hợp gồm 16 8g bột fe và 6,4 g lưu huỳnh (điều kiện ko có kk)đến phản ứng hoàn toàn thu được chất rắn a hòa tan A bằng hcl thu đuộc hh khí B chia b làm 2 phần p1 cho lội từ từ qua cucl2 thấy m g kết tủa cus đen phần 2 đem đốt tromng õi cần v lít tính m v
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



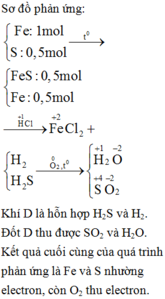
Fe + S -----> FeS
FeS + 2 HCl ----> FeCl2 + H2S
Fe + 2HCl ----> FeCl2 + H2
a) n(Fe) = 5,6 : 56 = 0,1 ( mol)
n ( S ) = 1,5 : 32 = 0,05 ( mol )
=> sau phản ứng thứ nhất : n(Fe) dư = 0,1 - 0,05 = 0,05 mol ; n(FeS) =n (S ) = 0,05 ( mol)
a) Các chất rắn trong B là: Fe và FeS
Các chất trong dung dịch A là : FeCl2 và HCl dư
b) n(H2 S) = n ( FeS ) = 0,05 ( mol) => V( H2S) = 0,05 x 22,4 = 1,12 ( lit)
n (H2 ) = n(Fe dư) = 0,05 ( mol ) => V( H2) = 1,12 ( lit)

Ta có pthh:
\(Fe+S\underrightarrow{t^o}FeS\left(1\right)\)
x1 x1 x1 (mol)
Sau khi nung trong hỗn hợp A có :
\(\left(x-x_1\right)molS\)
\(\left(2x-x_1\right)molFe\)
và x1 mol FeS
- hòa tan A trong axit HCl dư :
\(Fe+2HCl\rightarrow FeCL_2+H_2\uparrow\left(2\right)\)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\left(3\right)\)
Còn lại 0,4 g chất rắn B là lưu huỳnh dư
\(nS=x-x_1=\dfrac{0,4}{32}=0,0125\left(mol\right)\left(I\right)\)
Dung dịch C gồm HCl dư và FeCl2 với số mol là 2x .
Khí D gồm H2 và H2S .
Sục khí D từ từ vào dung dịch CuCl2 dư , chỉ có H2S phản ứng.
\(CuCl_2+H_2S\rightarrow CuS\downarrow+2HCl\left(4\right)\)
Kết tủa đen tạo thành là CuS
theo (1) (2) , (4) :
\(nCuS=x_1=\dfrac{4,8}{96}=0,05\left(mol\right)\left(II\right)\)
Kết hợp (I) ; và (II) ta có : x - x1= 0,0125
x = 0,0125 + 0,05 = 0,0625
Hiệu suất pứ tạo thành hh A:
Theo S: \(h\%=\dfrac{0,05}{0,0625}.100\%=80\%\)

Đáp án C.
Mg + S → MgS
MgS + 2HCl → MgCl2 + H2S
Mg + 2HCl → MgCl2 + H2
nMg = 0,2 (mol); nS = 0,15 (mol)
nH2S = nMgS = nS = 0,15 mol;
nH2= nMg (dư) = 0,2 – 0,15 = 0,05 (mol)
=> MY = (0,15.34+0,05.2)/(0,15+0,05)=26

\(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
\(n_S=\dfrac{9,6}{32}=0,3\left(mol\right)\)
Do khi hòa tan A vào HCl thu được hỗn hợp khí
=> Trong A chứa H2, H2S
=> Al dư, S hết
PTHH: 2Al + 3S --to--> Al2S3
0,2<--0,3------>0,1
2Al + 6HCl --> 2AlCl3 + 3H2
0,1----------------------->0,15
Al2S3 + 6HCl --> 2AlCl3 + 3H2S
0,1------------------------>0,3
=> \(\overline{M}_X=\dfrac{0,15.2+0,3.34}{0,15+0,3}=\dfrac{70}{3}\left(g/mol\right)\)
=> \(d_{X/H_2}=\dfrac{\dfrac{70}{3}}{2}=\dfrac{35}{3}\)

Đáp án B
Mg + S → MgS
MgS + 2HCl → MgCl2 + H2S
Mg + 2HCl → MgCl2 + H2
nMg = 0,2 (mol), nS = 0,15 9mol)
nH2S = nMgS = nS = 0,15 mol;
nH2 = nMg (dư) = 0,2 – 0,15 =0,05 (mol)