giúp mình câu này được không ạ , mình cần gấp lắm,chiều thi rồi Hoà tan 3,1 gam Na2O VÀO cố nước chứa 46,9 gam nước a) Tính nồng độ phần trăm dung dịch thu được b)Tính nồng độ mol của dung dịch. Biết sự hoà tan chất rắn vào nước thì thể tích thay đổi không đang kể ( D H2O = 1G/ML )
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


gọi CTC của oxit là R2O3, đặt số mol R2O3 là 0.1(mol)
R2O3+6HCl-->2RCl3+3H2O
0.1 0.6 0.2 0.3 (mol)
C%ddHCl= 0.6x36.5x100/mdd=18.25
==>mddHCl=120(g)
C%ddspu=0.2x(R+35.5x3)x100/[0.1x(2R+48)+120]=23.897
==> R=56 : Fe
C% despite= 0,2x(R+35,5x3) x100/ [0.1x(2R+48)+120]=23.897.LLàm phiền bạn có thể giải thích cho mình rõ hơn chỗ phép tính này đk ko?

\(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\\ a,CuO+H_2SO_4\rightarrow CuSO_4+H_2O\\ b,n_{H_2SO_4}=n_{CuSO_4}=n_{CuO}=0,1\left(mol\right)\\ C_{MddH_2SO_4}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)
c, Cần có thêm KLR của dung dịch axit mới tính được em ha

Đáp án B
Số mol H2 = 0,1 mol
Phương trình phản ứng:
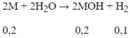
Tính được M = m : n = 7,8 : 0,2 = 39. Vậy kim loại cần tìm là K.
C M = 0 , 2 0 , 1 = 2 M

a, Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH:
Fe + 2HCl ---> FeCl2 + H2
a--->2a------------------>a
2Al + 6HCl ---> 2AlCl3 + 3H2
b---->3b-------------------->1,5b
=> \(\left\{{}\begin{matrix}56a+27b=16,6\\a+1,5b=0,5\end{matrix}\right.\Leftrightarrow a=b=0,2\left(mol\right)\)
=> \(\left\{{}\begin{matrix}m_{Fe}=0,2.56=11,2\left(g\right)\\m_{Al}=0,2.27=5,4\left(g\right)\end{matrix}\right.\)
b) \(C\%_{HCl}=\dfrac{\left(0,2.2+0,2.3\right).36,5}{300}.100\%=12,167\%\)
\(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
gọi nFe : a , nAl: b (a,b>0) => 56a + 27b = 16,6 (g)
\(pthh:Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a a
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
b \(\dfrac{3b}{2}\)
=> \(a+\dfrac{3b}{2}=0,5\)
ta có hệ pt
\(\left\{{}\begin{matrix}56a+27b=16,6\\a+\dfrac{3b}{2}=0,5\end{matrix}\right.\)
=> a= 0,2 , b = 0,2
\(\left\{{}\begin{matrix}m_{Fe}=0,2.56=11,2\left(g\right)\\m_{Al}=16,6-11,2=5,4\left(g\right)\end{matrix}\right.\)
\(pthh:Fe+2HCl\rightarrow FeCl_2+H_2\)
0,2 0,4
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,2 0,6
=> \(m_{HCl}=\left(0,4+0,6\right).36,5=36,5\left(g\right)\)
=> \(C\%=\dfrac{36,5}{200}.100\%=18,25\%\)

Ta có ptpu
MgCO3+ 2HCl ----> MgCl2 + H2O+ CO2
\(n_{MgCO3}\)= \(\frac{9,6}{84}\)= \(\frac{0,8}{7}\) ( mol)
\(m_{HCl}\)= \(\frac{14,6}{100}.100\)= 14,6(g)
=> \(n_{HCl}\)= \(\frac{14,6}{36,5}=0,4\left(mol\right)\)
Theopt ta thấy sau phản ứng HCl dư và dư \(\frac{1,2}{7}\) mol==> m dư= 6,26 (g)
=> \(n_{CO2}\)= \(n_{MgCO3}\)= \(\frac{0,8}{7}\) mol
=> \(V_{CO2}\)= \(\frac{0,8}{7}.22,4=2,56\left(l\right)\)
b)
Ta có \(m_{CO2}\)= \(\frac{0,8}{7}.44=\frac{35,2}{7}\left(g\right)\)
\(m_{H2O}\)= \(\frac{0,8}{7}.18=\frac{14,4}{7}\)( g)
\(m_{MgCl2}\)= \(\frac{0,8}{7}.95=\frac{76}{7}\)(g)
=> \(m_{dd_{MgCl2}}\)= (9,6+100)-( \(\frac{49,6}{7}\))= 102,5(g)
=> \(C\%_{MgCl2}\)= \(\frac{\frac{76}{7}}{102,5}\). 100%= 10,6 ( %)
\(C\%_{HCl_{dư}}\)= \(\frac{6,26}{102,5}.100\)=6,107 ( %)
đề có hơi vô lý một tý nha: hỗn hợp thì phải 2 chất trở lên, nhưng trong đề chỉ có mỗi MgCO3....Đề ghi vậy thì anh làm theo đề nha
mHCl=(14.6*100)/100=14.6g=>nHCl=0.4 mol
nMgCO3=9.6/84=4/35\(\approx\) 0.114mol
theo pthh,HCl dư 2/7 mol=>mHCl dư=73/7g
MgCO3+2HCl --> MgCl2 + CO2+H2O
4/35 0.4 4/35 4/35
a)Vco2=(4/35)*22.4=2.56l
b)C%HCl dư=(73/7)/100*100=76/7\(\approx\) 10.42%
mMgCl2=4/35*95=76.7g
C%MgCl2=(76.7)/100*100=76/7\(\approx\) 10.85%
Chúc em học tốt!!1
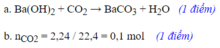
md d =mct + mdm =3,1+46,9=50(gam)
=> \(C\%=\dfrac{m_{ct}.100\%}{m_{dd}}=\dfrac{3,1.100}{50}=6,2\left(\%\right)\)
b) Vì Dnước=1g/mol nên mnước=Vnước
Theo bài ,sự hòa tan chất rắn vào nước thay đổi không đáng kể nên Vd d=Vnước=46,9(lít)
nd d=\(\dfrac{m_{dd}}{M_{dd}}=\dfrac{50}{40}=1,25\left(mol\right)\)
=> \(C_M=\dfrac{n}{V}=\dfrac{1,25}{46,9}\approx0,03\left(M\right)\)
Bạn kiểm tra lại giùm mình đi ,sai chỗ nào thì nhận xét giùm mình nhé
ai giúp mình với ,please