Từ 1,6 tấn quặng có chứa 60% FeS2, người ta có thể sản xuất được bao nhiêu gam dung dịch axit H2SO4 98%, nếu hiệu xuất đó là 90%.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C.
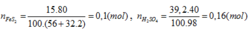
FeS2→ 2H2SO4
0,08 ← 0,16 (mol)
H% = 0,08.100/0,1= 80%

Đổi 1,2 tấn = 1200 kg
Ta có: \(n_{FeS_2}=\dfrac{1200}{120}=10\left(kmol\right)\)
Bảo toàn Lưu huỳnh: \(n_{H_2SO_4\left(lý.thuyết\right)}=2n_{FeS_2}=20\left(kmol\right)\)
\(\Rightarrow m_{ddH_2SO_4\left(thực\right)}=\dfrac{20\cdot98}{50\%}\cdot80\%=3136\left(kg\right)=3,136\left(tấn\right)\)

\(m_{FeS_2}=3.60\%=1,8\left(tấn\right)\)
Sơ đồ cả quá trình tạo H2SO4
FeS2 \(\rightarrow\) 2SO2 \(\rightarrow\) 2SO3 \(\rightarrow\) 2H2SO4
Giả sử: 120 tấn---------------------->196 tấn
1,8 tấn------------------------> x tấn
\(\Rightarrow m_{H_2SO_4\left(lt\right)}=x=\frac{1,8.196}{120}=2,94\left(tấn\right)\)
Vì H=95% => \(m_{H_2SO_4}=2,94.95\%=2,793\left(tấn\right)\)

\(m_S=1000\cdot98\%=980\left(kg\right)\)
\(n_S=\dfrac{980}{32}=30.625\left(kmol\right)\)
\(S\rightarrow SO_2\rightarrow SO_3\rightarrow H_2SO_4\)
\(30.625.........................30.625\)
\(m_{dd_{H_2SO_4}}=\dfrac{30.625\cdot98}{98\%}=3062.5\left(kg\right)\)
\(m_{dd_{H_2SO_4\left(tt\right)}}=3062.5\cdot98\%=3001.25\left(kg\right)\)
mFeS2=1,6 . \(\dfrac{60}{100}\) =0,96 tấn
Sơ đồ: FeS2--->2SO2--->2SO3--->2H2SO4
0,96 tấn 1,568 tấn
H=\(\dfrac{mtt}{mlt}\times100\%\) => mtt=H . mlt: 100% =90% .1,568:100%
=1,4112 tấn
Vậy từ 1,6 tấn quặng người ta điều chế đc 1,4112 tấn H2SO4
khối lượng theo lí thuyết của axit sunfuric là 1,568 ở pt . Mình ấn máy bị lỗi mong bạn thông cảm