hòa tan 6,44 gam hỗn hợp gồm sắt, magie, kẽm bằng 1 lượng vừa đủ dung dịch axit sunfuric loãng thu được 0,12 mol khí hiđro và dung dịch chứa hỗn hợp các muối. Tính khối lượng hỗn hợp muối thu được.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn đáp án C
Đặt nCu2S = x. Bảo toàn nguyên tố S: nSO42–/A = (0,24 + x) mol.
||⇒ A chứa 0,12 mol Fe3+; 2x mol Cu2+ và (0,24 + x) mol SO42–.
► Bảo toàn điện tích: 0,12 × 3 + 2x × 2 = 2 × (0,24 + x) ⇒ x = 0,06 mol.
⇒ mmuối = 0,12 × 56 + 0,12 × 64 + 0,3 × 96 = 43,2(g) ⇒ chọn C.

a)
$Mg + H_2SO_4 \to MgSO_4 + H_2$
$MgO + H_2SO_4 \to MgSO_4 + H_2O$
n Mg = n H2 = 2,24/22,4 = 0,1(mol)
%m Mg = 0,1.24/6,4 .100% = 37,5%
%m MgO = 100% -37,5% = 62,5%
b)
=> n MgO = (6,4 - 0,1.24)/40 = 0,1(mol)
=> n H2SO4 = n Mg + n MgO = 0,2(mol)
=> C% H2SO4 = 0,2.98/200 .100% = 9,8%
c)
n MgSO4 = n Mg + n MgO = 0,2(mol)
Sau phản ứng :
m dd = 6,4 + 200 - 0,1.2 = 206,2(gam)
C% MgSO4 = 0,2.120/206,2 .100% = 11,64%

Định hướng tư duy giải
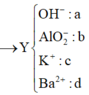

=> 0,12.35,5 + 96(0,04 – d) + 39c + 9(0,2 – 2d – c) = 9,42.
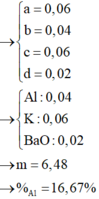

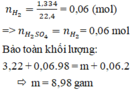



Sơ đồ: Fe , Mg, Zn (+H2SO4)----->FeSO4,MgSO4 , ZnSO4, H2 , H2O
2H+ +2e --->H2
0,24 0,12
mmuối=mKL+mSO4=6,44+96.nSO4=6,64+96.\(\dfrac{1}{2}\)nH+ = 6,64+96.\(\dfrac{1}{2}\).0,24
=18,16 g