Qúa trình sản xuất axit H2SO4 từ quặng pirit diễn ra 3 giai đoạn theo sơ đồ sau:
FeS2 \(\rightarrow\) SO2 \(\rightarrow\) SO3 \(\rightarrow\) H2SO4
Hiệu suất mỗi giai đoạn lần lượt là 70%, 80%, 90%. Hỏi từ 250 tấn quặng pirit chứa 60% FeS2 có chế được bao nhiêu tấn dung dịch H2SO4 98%

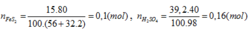


\(m_{FeS_2}=\dfrac{250.60}{100}=150\left(tấn\right)\)
\(\Rightarrow n_{FeS_2}=1,25\left(tấn-mol\right)\)
Ta có PTHH :
\(4FeS_2+11O_2\underrightarrow{t^0}2Fe_2O_3+8SO_2\left(1\right)\)
Mà theo bài ra ta có ;
- \(H=70\%\)
\(\Rightarrow n_{SO_2}=1,75\left(tấn-mol\right)\)
\(2SO_2+O_2\underrightarrow{450^0-V_2O_5}2SO_3\left(2\right)\)
\(-H=80\%\)
\(\Rightarrow n_{SO_3}=1,4\left(tấn-mol\right)\)
\(SO_3+H_2O\rightarrow H_2SO_4\left(3\right)\)
\(-H=90\%\)
\(\Rightarrow n_{H_2SO_4}=1,26\left(tấn-mol\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{1,26.98.100}{98}=126\left(tấn\right)\)