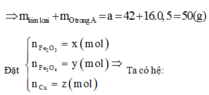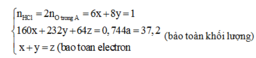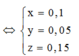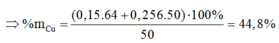Cho 45.5g hôn hợp gồm : Zn, Cu, Cu vào dung dịch axit HCl dư thì còn lại 32.5g chất ko tan. Mặt khác cũng lấy 45.5g hỗn hợp kim loại trên đem đốt thì khối lượng tăng lên thành 51.9g l. Tính thành phần % khối lượng mỗi kim loại trong hỗn hợp
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl -->ZnCl2 + H2
____0,2<----------------------0,2
=> mZn = 0,2.65 = 13 (g)
mCu = mrắn không tan = 19,5 (g)
\(\left\{{}\begin{matrix}\%Zn=\dfrac{13}{13+19,5}.100\%=40\%\\\%Cu=\dfrac{19,5}{13+19,5}.100\%=60\%\end{matrix}\right.\)
`n_(H_2)=4,48/22,4=0,2 (mol)`
Ta có PTHH: `Zn+2HCl --> ZnCl_2 +H_2`
Theo PT: `1`--------------------------------`1`
Theo đề: `0,2`------------------------------`0,2`
`m_(Zn)=0,2.65=13(g)`
Vì `Cu` không phản ứng với `HCl` nên `m_(chất rắn không tan)=m_(Cu)=19,5(gam)`
`%Zn=13/(13+19,5) .100%=40%`
`%Cu=100%-40%=60%`

Ta có nH2 = \(\dfrac{4,48}{22,4}\) = 0,2 ( mol )
Cu và Ag không tác dụng được với HCl
Zn + 2HCl \(\rightarrow\) ZnCl2 + H2
0,2................................0,2
=> mZn = 65 . 0,2 = 13 ( gam )
Zn + \(\dfrac{1}{2}\)O2 \(\rightarrow\) ZnO
0,2..................0,2
=> mZnO = 0,2 . 81 = 16,2 ( gam )
=> mCuO + Ag2O = 51,9 - 16,2 = 35,7 ( gam )
Ta có mCu + Ag = 45,5 - 13 = 32,5 ( gam )
Cu + \(\dfrac{1}{2}\)O2 \(\rightarrow\) CuO
x.......................x
2Ag + \(\dfrac{1}{2}\)O2 \(\rightarrow\) Ag2O
y.........................y/2
=> \(\left\{{}\begin{matrix}80x+232\dfrac{y}{2}=35,7\\64x+108y=32,5\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=0,07\\y=0,26\end{matrix}\right.\)
=> mCu = 64 . 0,07 = 4,48 ( gam )
=> mAg = 32,5 - 4,48 = 28,02 ( gam )

a) Gọi số mol Zn, Cu, Ag là a, b, c
=> 65a + 64b + 108c = 45,5 (1)
Phần rắn không tan gồm Cu, Ag
=> 64b + 108c = 32,5 (2)
(1)(2) => a = 0,2 (mol)
\(n_{O_2}=\dfrac{51,9-45,5}{32}=0,2\left(mol\right)\)
PTHH: 2Zn + O2 --to--> 2ZnO
0,2---->0,1
2Cu + O2 --to--> 2CuO
b---->0,5b
=> 0,1 + 0,5b = 0,2
=> b = 0,2
\(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,2.65}{45,5}.100\%=28,57\%\\\%m_{Cu}=\dfrac{0,2.64}{45,5}.100\%=28,13\%\\\%m_{Ag}=\dfrac{45,5-0,2.65-0,2.64}{45,5}.100\%=43,3\%\end{matrix}\right.\)
b)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,2-->0,4
=> mHCl = 0,4.36,5 = 14,6 (g)
=> \(m_{ddHCl}=\dfrac{14,6.100}{10}=146\left(g\right)\)

a) Theo đề bài: \(m_{Cu}=0,3\left(g\right)\)
PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
a______2a______a_____a (mol)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
b_____2b______b____b (mol)
Ta lập được hệ phươn trình: \(\left\{{}\begin{matrix}24a+56b=18,7-0,3=18,4\\a+b=\dfrac{11,2}{22,4}=0,5\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,3\\b=0,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,3\cdot24=7,2\left(g\right)\\m_{Fe}=0,2\cdot56=11,2\left(g\right)\end{matrix}\right.\)
b) PTHH: \(Cu+2H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}CuSO_4+SO_2+2H_2O\)
Ta có: \(n_{Cu}=\dfrac{0,3}{64}=\dfrac{3}{640}\left(mol\right)=n_{SO_2}\) \(\Rightarrow V_{SO_2}=\dfrac{3}{640}\cdot22,4=0,105\left(l\right)\)
a)
Gọi $n_{Mg} = a(mol) ; n_{Fe} = b(mol)$
$Mg + 2HCl \to MgCl_2 + H_2$
$Fe + 2HCl \to FeCl_2 + H_2$
$n_{H_2} = a + b = \dfrac{11,2}{22,4} = 0,5(mol)$
$m_X = 24a + 56b = 0,3 = 18,7(gam)$
Suy ra a = 0,3 ; b = 0,2
$m_{Mg} = 0,3.24 = 7,2(gam)$
$m_{Fe} = 0,2.56 = 11,2(gam)$
b)
$Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + H_2O$
$n_{SO_2} = n_{Cu} = \dfrac{0,3}{64}$
$V = \dfrac{0,3}{64}.22,4 = 0,105(lít)$

Đáp án A
Vì còn lại một phần chất rắn không tan nên Cu dư và trong dung dịch chứa FeCl2 và CuCl2
Có nO(A) = 0,5nHCl = 0,5
a = mkim loại + mO(A) = 42 + 16.0,5 = 50 (gam)
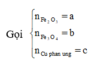
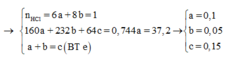
![]()