một hỗn hợp gồm 0.06 mol so2 và 0.06 mol o2 cho qua chất xúc tác v2o5 nung nóng ở 400 C thu được hỗn hợp X với hiệu suất 80%.cho X hấp thụ hoàn toàn vào 200 ml dd H2SO4 20% (d=1.14 g/ml) thu được dd X1 .tính C% của H2SO4 trong dd X1
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án : B
SO2 + 0,5O2 -> SO3
H tính theo SO2 => nSO3 = 0,1.0,8 = 0,08 mol = nBaSO4
=> mBaSO4 = 18,64g ( SO2 không phản ứng với BaCl2)

Hỗn hợp A ban đầu có SO2 : a mol, N2: 4a mol và O2: a mol.
Phản ứng:
2SO2 + O2< --> 2SO3 (XT: V2O5, t0) (1)
Gọi số mol SO2 phản ứng là x.
Theo (1): Số mol giảm = số mol O2 phản ứng = 0,5x mol
=> nB = 6a – 0,5x mol
Theo định luật bảo toàn khối lượng: mA = mB = m
\(d_{A/B}=\dfrac{m}{6a}:\dfrac{m}{6a-0,5x}=\dfrac{6a-0,5x}{6a}=0,93\)
\(\Rightarrow\dfrac{x}{a}=0,84\)
\(VậyH\%=84\%\)

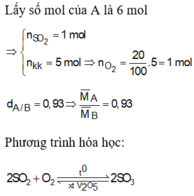
Hỗn hợp A ban đầu có SO2: a mol, N2: 4a mol và O2: a mol.
Phản ứng:
2SO2 + O2 <=> 2SO3 (XT: V2O5, t\(^o\)) (1)
Gọi số mol SO2 phản ứng là x.
Theo (1): Số mol giảm = số mol O2 phản ứng = 0,5x mol
=> nB = 6a – 0,5x mol
Theo định luật bảo toàn khối lượng: mA = mB = m
dA/B = \(\dfrac{m}{6a}:\) \(\dfrac{m}{6a-0,5x}\) \(=\dfrac{6a-0,5x}{6a}\) = 0,93
=> \(\dfrac{x}{a}\) = 0,84
Vậy H% = 84%.

Đáp án D
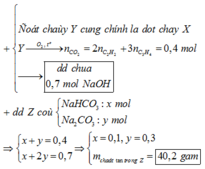
hhX gồm 0,05 mol C2H2; 0,1 mol C3H4 và 0,1 mol H2.
Nung hhX với Ni → hhY gồm 7 chất. Đốt cháy Y rồi cho sản phẩm + 0,7 mol NaOH → ddZ.
• Đốt cháy hhY cũng chính là đốt cháy hhX ban đầu.
→ nCO2 = 0,05 x 2 + 0,1 x 3 = 0,4 mol.
hhZ gồm nNa2CO3 = x mol; nNaHCO3 = y mol.
Ta có hpt:
2
x
+
y
=
0
,
7
x
+
y
=
0
,
4
⇔
x
=
0
,
3
y
=
0
,
1
→ mZ = 0,3 x 106 + 0,1 x 84 = 40,2 gam
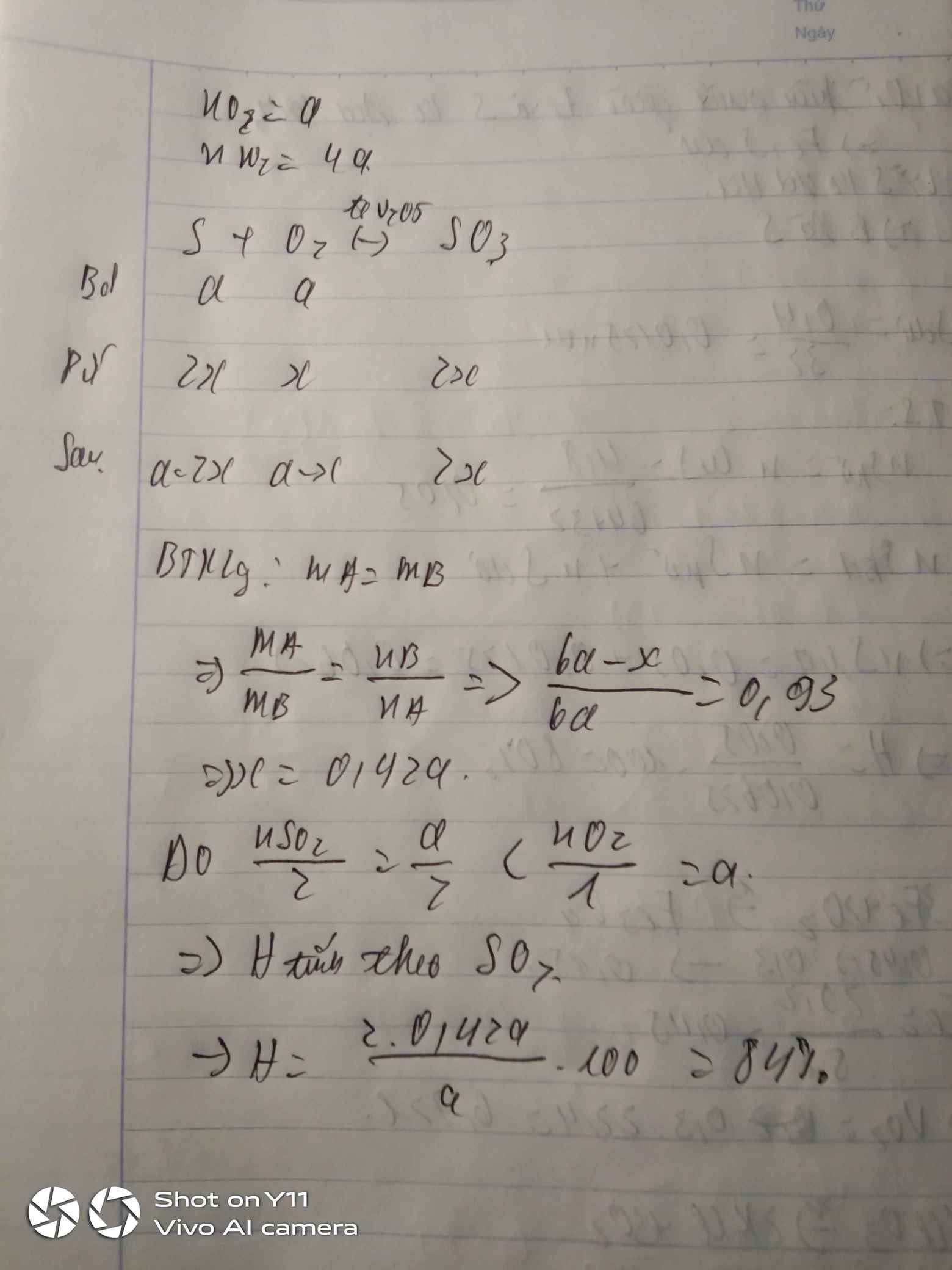




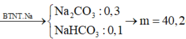
\(2SO_2\left(0,06\right)+O_2\left(0,03\right)\xrightarrow[V_2O_5]{400^oC}2SO_3\left(0,06\right)\)
\(n_{SO_2}=0,06\left(mol\right)\)
\(n_{O_2}=0,06\left(mol\right)\)
Dựa vào PTHH, ta có O2 dư sau phản ứng, chon nSO2 để tính.
\(n_{SO3}\left(lt\right)=0,06\left(mol\right)\)
Vì \(H=80%\)\(\%\)
\(\Rightarrow n_{SO_3}\left(tt\right)=\dfrac{0,06.80}{100}=0,048\left(mol\right)\)
\(n_{O_2}\left(pứ\right)=0,03\left(mol\right)\)
\(\Rightarrow\)Hỗn hợp X: \(\left\{{}\begin{matrix}SO_3:0,048\left(mol\right)\\O_2\left(dư\right):0,06-0,03=0,03\left(mol\right)\end{matrix}\right.\)
Khi cho X hấp thụ hoàn toàn vào 200 ml dd H2SO4 20% thì chỉ có SO3 tác dụng còn khí O2 thoát ra:
\(m_{ddH_2SO_4}=1,14.200=228\left(g\right)\)
\(\Rightarrow m_{H_2SO_4}\left(bđ\right)=\dfrac{20.228}{100}=45,6\left(g\right)\)
\(SO_3\left(0,048\right)+H_2O--->H_2SO_4\left(0,048\right)\)
\(m_{H_2SO_4}\left(tao-thanh\right)=0,048.98=4,704\left(g\right)\)
\(\Rightarrow m_{H_2SO_4}\left(sau\right)=45,6+4,704=50,304\left(g\right)\)
Nồng độ phần trăm của H2SO4 trong dung dich X1 là:
\(C\%_{H_2SO_4}=\dfrac{50,304}{228}.100\%=20,06\%\)