Điệp phân 45g nhôm (III) oxit thu đc 3,6g Al lim loại . Tính hiệu suất PƯ.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Sửa đề thành 0,54 gam Al cho số mol đẹp bạn nhé!
PT: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
Ta có: \(n_{Al}=\dfrac{0,54}{27}=0,02\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{H_2SO_4}=n_{H_2}=\dfrac{3}{2}n_{Al}=0,03\left(mol\right)\\n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}=0,01\left(mol\right)\end{matrix}\right.\)
a, Ta có: \(n_{H_2}=0,03.22,4=0,672\left(l\right)\)
b, \(m_{H_2SO_4}=0,03.98=2,94\left(g\right)\)
c, \(m_{Al_2\left(SO_4\right)_3}=0,01.342=3,42\left(g\right)\)
Bạn tham khảo nhé!

a) \(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
______0,3--------------->0,15
=> \(m_{Al_2O_3\left(PTHH\right)}=0,15.102=15,3\left(g\right)\)
=> mAl2O3 (thực tế) = \(\dfrac{15,3.100}{90}=17\left(g\right)\)

Khá nhiều bạn sẽ rập khuôn cách giải sau: n A l = 1 15
Ta có phản ứng:
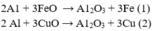
Đặt
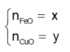
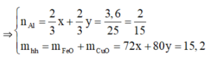
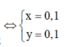
Từ (1) và (2) suy ra
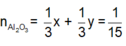
![]()
n F e = x = 0 , 1 = > m F e = 0 , 1 . 56 = 5 , 6 g
n C u = y = 0 , 1 = > m C u = 0 , 1 . 64 = 6 , 4 g
m = m A l 2 O 3 + m F e + m C u = 6,8 + 5,6 + 6,4 = 18,8 g
Đáp án A.

Lượng nhôm oxit có trong 0,5 tấn quặng là : 0,5x50/100 = 0,25 tấn = 250kg
Phương trình hoá học điều chế Al :
2 Al 2 O 3 → 4Al + 3 O 2
Khối lượng Al nguyên chất thu được từ 250 kg quặng :
x = 250x4x27/(2x102) = 132,4(kg)
Khối lượng Al lẫn tạp chất: 132,4 x 101,5% = 134,386 (kg).

B3: Gọi M là tên kim loại hóa trị III=>oxit của nó là M2O3
mct(H2SO4)=294*20/100=58.8(g)
=>nH2SO4=58.8/98=0.6(mol)
M2O3+3H2SO4=>M2(SO4)3+3H2O
0.2----->0.6(mol)
=>nM2O3=0.6/3=0.2(mol)
=>M2O3=32/0.2=160(g)
=>M=160-48/2=56(g)=>Fe
Vậy công thức của oxit kim loại là Fe2O3.

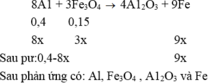
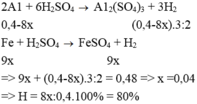
PTHH: 2Al2O3 --đp--> 4Al + 3O2
nAl2O3 = \(\dfrac{m}{M}=\dfrac{45}{2.27+3.16}\text{≈ }0,44mol\)
nAl(tt) = \(\dfrac{m}{M}=\dfrac{3,6}{27}\text{≈ }0,13mol\)
So sánh hai số mol:
\(\dfrac{nAl_2O_3\left(pt\right)}{nAl_2O_3\left(tt\right)}:\dfrac{nAl\left(pt\right)}{nAl\left(tt\right)}=\dfrac{2}{0,44}:\dfrac{4}{0,13}\) ≈ 4,55 : 30,77 => Al dư, tính theo Al2O3
nAl(lt) = \(\dfrac{0,44.4}{2}=0,88mol\)
Hiệu suất phản ứng:
H% = \(\dfrac{nAl\left(tt\right)}{nAl\left(lt\right)}.100=\dfrac{0,13}{0,88}.100\text{≈ }14,77\%\)