hòa tan hoàn toàn 6.66(g) tinh thể Al2(SO4)3.nH2O vào nước tạo thành 200(g) dd 3%.Xác định n
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


$n_{Na_2CO_3} = n_{Na_2CO_3.10H_2O} = \dfrac{28,6}{286} = 0,1(mol)$
$C_{M_{Na_2CO_3}} = \dfrac{0,1}{0,2} = 0,5M$
$m_{dd} = D.V = 200.1,05 = 210(gam)$
$C\%_{Na_2CO_3} = \dfrac{0,1.106}{210}.100\% = 5,05\%$

Số mol kết tủa tạo thành:
n(BaSO4) = 0,699/233 = 0,003mol
Al2(SO4)3 + 3BaCl2 → 3BaSO4 + 2AlCl3
0,001 0,003
Số mol Al2(SO4)3 có trong dung dịch A:
n[Al2(SO4)3] = 0,001.10 = 0,01mol
Khối lượng mol phân tử của muối hidrat:
M[Al2(SO4)3.nH2O] = 342 + 18n = 6,66/0,01 = 666
→ n = (666-342)/18 = 18
Vậy công thức tinh thể muối nhôm sunfat là Al2(SO4)3.18H2O

3BaCl2 + Al2(SO4)3→ 3BaSO4 + 2AlCl3
nBaSO4=\(\frac{0,699}{137+32+16.4}=0,003\) mol
theo PT => nAl2(SO4)3=0,001mol
vì lấy 1/10=> nAl2(SO4)3 ban đầu=0,01 mol
=>MAl2(SO4)3.nH2O=\(\frac{6,66}{0,01}=666\)
=> 27.2+3(32+16.4)+18n=666
<=>n=18
vậy công thức hidrat trên là Al2(SO4)3.18H2O

nBaSO4=0,003 mol
Áp dụng định luật bảo toàn nguyên tố ta có
=> nSO4=0,003mol
=> nAl2(SO4)3=nSO4/3=0,001mol
=> Trong ddA nAl2(SO4)3=0,001 . 10=0,01mol
=>mAl2(SO4)3=0,01 . 342=3,42g
=>mH2O= 6,66 - 3,42 = 3,24 gam
=>nH2O=0,18 mol
=> nAl2(SO4)3 : nH2O=0,01: 0,018=1:18
=> CT tinh thể Al2(SO4)3.18H2O

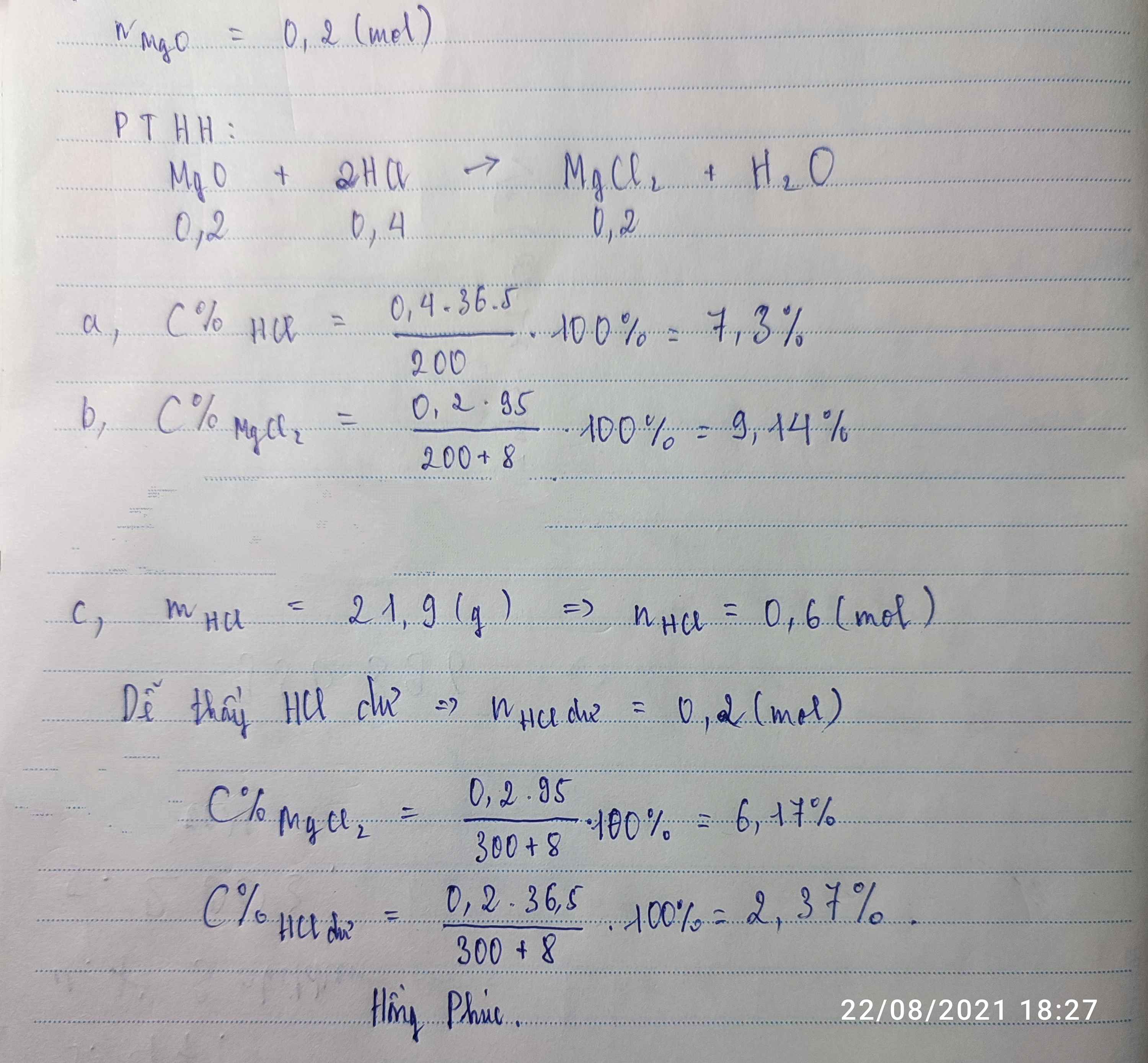
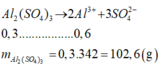
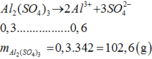
*mAl2(SO4)3 / dd sau trộn = \(\dfrac{C\%.m_{dd}}{100\%}=\dfrac{3\%.200}{100\%}=6\left(g\right)\)
=> mAl2(SO4)3 / muối tinh thể = 6 (g)
=> nAl2(SO4)3/ muối tinh thể = 6/342 =1/57 (mol)
* mH2O / muối tinh thể = 6,66 - 6 =0,66(g)
=> nH2O / muối tinh thể = 0,66 : 18 = 11/300 (mol)
*Trong Al2(SO4)3 . nH2O có :
nH2O = n . nAl2(SO4)3
=> 11/300 =n . 1/57 => n = 2
Vậy n =2