Đốt cháy hoàn toàn 2,04 gam hợp chất A, thu được 1,08 g H2O và 1,344 l SO2 (đktc).
a) Hãy xác định công thức phân tử của hợp chất A.
b) Dẫn toàn bộ lượng hợp chất A nói trên qua dung dịch axit sunfuric đặc thấy có kết tủa màu vàng xuất hiện.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Xác định công thức phân tử của hợp chất A
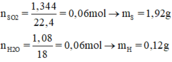
Như vậy hợp chất A chỉ có nguyên tố S và H (Do mS + mH = 1,92 + 0,12 = 2,04 =mA)
Đặt công thức phân tử hợp chất là HxSy
Ta có tỉ lệ x : y = nH : nS = 0,12 : 0,06 = 2 : 1
Vậy công thức phân tử của A và là H2S.

Phương trình hóa học của phản ứng:
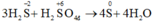
Do H2S có tính khử và H2SO4 có tính oxi hóa nên chúng có khả năng tác dụng với nhau sinh ra kết tủa vàng là S
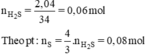
mS = 0,08 × 32 = 2,56g.

Công thức phân tử của hợp chất A :
Số mol các sản phẩm của phản ứng :
n SO 2 = 0,1 mol; n H 2 O = 0,1 mol
Khối lượng của hiđro có trong 0,1 mol H 2 O (2 g.0,1 = 0,2 g) và khối lượng của lưu huỳnh có trong 0,1 mol SO 2 (32 g.0,1 = 3,2 g) đúng bằng khối lượng của hợp chất A đem đốt (3,4 g).
Vậy thành phần của hợp chất A chỉ có 2 nguyên tố là H và S.
- Tỉ lệ giữa số mol nguyên tử H và số mol nguyên tử S là :
n H : n S = 0,1.2 : 0,1 = 2 : 1
Công thức phân tử của hợp chất A là : H 2 S

n H2O = 1,08 / 18 = 0,06 (mol)
=> nH = 0,06 x 2 = 0,12 (mol)
=> mH = 0,12 x 1 = 0,12 (g)
n SO2 = 1,344 / 22,4 = 0,06 (mol)
=> n S = 0,06 (mol)
=> m S = 0,06 x 32 = 1,92 (g)
Vì: mO = mhh - mS - mH = 2,04 - 1,92 - 0,12 = 0 => Không có Oxi
Gọi HxSy là chất cần tìm
nH : nS = 0,12 : 0,06 = 2 : 1
=> Công thức đơn giản là (H2S)n
(H2S)n + 3n/2O2 --> nH2O + nSO2
____ __ _ __ _ _ _ _ 0,06 ----> 0,06n
lấy số mol nước đẩy qua số mol SO2 thì thấy 0,06n = 0,06 => n = 1
n H2S = 0,06 (mol)
Vậy đó là công thức H2S
2AgNO3 + H2S --> Ag2S + 2HNO3
0,06 ----> 0,06
=> m Ag2S = 0,06 x 248 = 14,88 g

a) Xác định công thức phân tử của hợp chất A.
=> mS = 1,92 gam
=> mH = 0,12 gam.
Như vậy hợp chất A chỉ gồm hai nguyên tố H và S.
Đặt công thức của hợp chất A là HxSy.
Ta có tỉ lệ y : x = 0,06 : 0,12 = 1 : 2.
Vậy công thức phân tử của A là H2S.
b) Phương trình hóa học của phản ứng.
3H2S + H2SO4 -> 4S + 4H2O
0,06 -> 0,08 (mol)
(mol)
Vậy mS = 0,08.32 = 2,56g.

Nồng độ phần trăm của các chất trong dung dịch :
Biết số mol NaOH (0,3 mol) nhiều hơn 2 lần số mol SO 2 (0,1 mol) vậy sản phẩm là muối Na 2 SO 3 . Ta có PTHH :
SO 2 + 2NaOH → Na 2 SO 3 + H 2 O
- Khối lượng của dung dịch sau phản ứng :
m dd = 146,6 + 3,4 = 150 (g)
- Khối lượng các chất có trong dung dịch sau phản ứng :
m Na 2 SO 3 = 126.0,1 = 12,6g
m NaOH dư = 40.(0,3 - 0,2) = 4g
- Nồng độ phần trăm các chất trong dung dịch sau phản ứng :
C % Na 2 SO 3 = 12,6/150 x 100% = 8,4%
C % NaOH dư = 4/150 x 100% = 2,67%
Xác định công thức phân tử của hợp chất A
nSO2 = 1,344 / 22,4 = 0,06 mol → mS = 0,06 x 32 = 1,92g
nH2O = 1,08 / 18 = 0,06 mol → mH = 0,06 x 2 = 0,12g.
Như vậy hợp chất A chỉ có nguyên tố S và H.
Đặt công thức phân tử hợp chất là HxSy.
Ta có tỉ lệ: x : y = 0,06 : 0,12 = 1: 2.
Vậy công thức phân tử của A và là H2S.
Phương trình hóa học của phản ứng:
nH2S = 2,04 / 34 = 0,06 mol.
3H2S + H2O → 4S + 4H2O.
nS = 4/3 nH2S = 0,08 mol.
mS = 0,08 × 32 = 2,56g.
Xác định công thức phân tử của hợp chất A
nSO2 = 1,344 / 22,4 = 0,06 mol → mS = 0,06 x 32 = 1,92g
nH2O = 1,08 / 18 = 0,06 mol → mH = 0,06 x 2 = 0,12g.
Như vậy hợp chất A chỉ có nguyên tố S và H.
Đặt công thức phân tử hợp chất là HxSy.
Ta có tỉ lệ: x : y = 0,06 : 0,12 = 1: 2.
Vậy công thức phân tử của A và là H2S.
Phương trình hóa học của phản ứng:
nH2S = 2,04 / 34 = 0,06 mol.
3H2S + H2O \(\rightarrow\) 4S + 4H2O.
nS = 4/3 nH2S = 0,08 mol.
mS = 0,08 × 32 = 2,56g.