Hòa tan hết 4g một kim loại M vào 96,2 gam nước thì thu được dung dịch A có nồng độ 7,4% và V lít khí B(đktc)
a. Xác định kim loại M
b. Tính V
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giai: 2M + 2xH2O → 2M(OH)x + xH2
amol a mol 0,5xa mol
Theo bài ra ta có: mkim loại = Ma = 4 gam (*)
=>mdd = Ma + 96,2 – 2.0,5xa = 4 + 96,2 – xa = 100,2 – xa
Khối lượng M(OH)x = (M+17x)a = Ma + 17xa = 4 + 17xa
=>C% của M(OH)x = 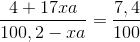
=>400 +1700xa = 741,48 – 7,4xa =>xa = 0,2 (**)
Từ (*) và (**): 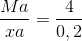
=>M = 20x
Lập bảng:
x 1 2 3
M 20 40 60
Kết luận / Ca /=>M là Ca(canxi)

a) \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: A + 2H2O --> A(OH)2 + H2
0,2<--------------0,2<-----0,2
=> \(M_A=\dfrac{8}{0,2}=40\left(g/mol\right)\)
=> A là Ca (Canxi)
b) \(C_M=\dfrac{0,2}{0,5}=0,4M\)

Gọi M là khối lượng mol trung bình của 2 nguyên tố
nH2=6.72/22.4=0.3 mol
M + H2O --> MOH + 1/2 H2
0.6mol---------------------0.3mol
-> M=20.2/0.3=67.3333
-->M1<67.33<M2
mà 2 kim loại này thuộc hai chu kì liên tiếp nhau
--> Kim loại đó là KI và Rb

\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: 2A + 2H2O --> 2AOH + H2
0,1<------------0,1<--0,05
=> \(M_A=\dfrac{2,3}{0,1}=23\left(g/mol\right)\)
=> A là Na (Natri)
\(C_{M\left(ddNaOH\right)}=\dfrac{0,1}{0,2}=0,5M\)

\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: 2A + 2H2O --> 2AOH + H2
0,2<-------------0,2<----0,1
=> \(M_A=\dfrac{7,8}{0,2}=39\left(g/mol\right)\)
=> A là Kali (K)
nKOH = 0,2 (mol)
=> \(C_{M\left(X\right)}=\dfrac{0,2}{0,2}=1M\)
a) Kim loại M là Li