Ngâm một lá kim loại có khối lượng 50 gam trong dung dịch HCl. Sau khi thu được 336ml khí H2 (đktc) thì khối lượng lá kim loại giảm 1,68 %. Kim loại đó là :
A.Zn. B.Fe.
C.Al. D.Ni.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B.
Khối lượng kim loại phản ứng là 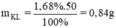
Số mol H2 là 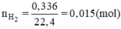
2M + 2n HCl → 2MCl2 + nH2
Số mol của M là:
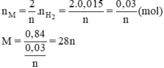
→ {n = 2, M = 56} → M: Fe
Đặt kim loại cần tìm là X, có hóa trị n
Khối lượng kim loại giảm 1,68% → mX phản ứng = 50.1,68% = 0,84 gam
PTHH: 2X+ 2nHCl → 2XCln + nH2
Ta có: nX = (2/n).nH2 ⇔ (0,84/X) = (0,015.2/n)
⇔ X = 28n
Vậy X là Fe
B nha

Chọn Đáp án B
Gọi n là hóa trị của kim loại R cần tìm
Ta có : $n_{H_2} =\dfrac{336}{1000.22,4} = 0,015(mol) ; m_{R\ phản\ ứng} = 50.1,68\% = 0,84(gam)$
$2R + 2nHCl \to 2RCl_n + nH_2$
Theo PTHH :
$n_{H_2} = \dfrac{2}{n}n_{H_2} = \dfrac{0,03}{n}(mol)$
$\Rightarrow \dfrac{0,03}{n}.R = 0,84$
$\Rightarrow R = 28n$
Với n = 2 thì R = 56(Fe)$

Đáp án C
mKL giảm = 50.1,68% = 0,84g = mKL phản ứng
nH2 = 0,336: 22,4 = 0,015 mol
Gọi kim loại cần tìm là M có hóa trị n
M + nHCl → MCln + 0,5nH2
=> nM = 2/n.nH2 = 0,03/n mol
=> MM = 0,84: (0,03/n) = 28n
Với n = 2 => MM = 56 g/mol (Fe)

Em kiểm tra đề nha
Kim loại không giảm khối lượng đâu em
A.Zn. B.Fe.
C.Al. D.Ni.
Đáp án B@Cẩm Vân Nguyễn Thị