1,a) Hòa tan hỗn hợp gồm 12,8g CuO và 16g Fe2O3 trong 155ml dung dịch H2SO4 2M đến khi phản úng xảy ra hoàn toàn. Sau Phản ứng thấy có m gam chất rắn không tan. Tính m.
b) Hòa tan hoàn toàn a gam CuO vào 420 dung dịch H2SO4 40% được dung dịch X chứa H2SO4 dư 14% và CuSO4 c%.
tính a và c%.
c) Để hòa tan hết a gam 1 khim loại M cần dùng 200g dung dịch HCl 7,3 % thu được dung dịnh MCl (duy nhất) có nồng độ phần trăm là 12,05%. Xác định M và tính a.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Khi cho X tác dụng với HCl: nHCl= 0,225.2= 0,45 mol
CuO + 2HCl→ CuCl2+ H2O
Fe2O3+ 6HCl→ 2FeCl3+ 3H2O
MgO + 2HCl→ MgCl2+ H2O
Đặt nCuO = x mol; n F e 2 O 3 = y mol; nMgO = z mol
→ 80x+ 160y +40z= 12 gam (1)
nHCl= 2x+6y+2z= 0,45 mol (2)
C O + C u O → t 0 C u + C O 2 x x m o l F e 2 O 3 + 3 C O → t 0 2 F e + 3 C O 2 y 2 y m o l
Chất rắn Y chứa x mol Cu; 2y mol Fe và z mol MgO
→ 64x + 56.2y + 40z= 10 gam (3)
Từ các PT(1,2,3) ta có x= 0,05; y=0,025; z=0,1
→% m F e 2 O 3 =33,33%

Gọi: \(\left\{{}\begin{matrix}n_{Fe_2O_3}=x\left(mol\right)\\n_{CuO}=y\left(mol\right)\end{matrix}\right.\) ⇒ 160x + 80y = 16 (1)
\(n_{HCl}=0,55.1=0,55\left(mol\right)\)
\(n_{H_2}=\dfrac{0,56}{22,4}=0,025\left(mol\right)\)
BTNT H, có: nHCl = 2nH2O + 2nH2 ⇒ nH2O = 0,25 (mol)
BTNT O, có: 3nFe2O3 + nCuO = nH2O ⇒ 3x + y = 0,25 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,05\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe_2O_3}=\dfrac{0,05.160}{16}.100\%=50\%\\\%m_{CuO}=50\%\end{matrix}\right.\)
Dd Y gồm: FeCl3: 0,1 (mol) và CuCl2: 0,1 (mol)
Dd Z gồm: FeCl2 và ZnCl2
Chất rắn T gồm: Cu, Fe
BTNT Cu: nCu = nCuCl2 = 0,1 (mol)
Ta có: \(n_{Fe\left(OH\right)_2}=\dfrac{4,5}{90}=0,05\left(mol\right)\)
BTNT Fe, có: nFeCl2 = 0,05 (mol) ⇒ nFe = 0,1 - 0,05 = 0,05 (mol)
BT e, có: 2nZn = 2nH2 + 2nCu + 3nFe + 2nFeCl2
⇒ nZn = 0,25 (mol)
⇒ m = 0,25.65 = 16,25 (g)

a)
n CuO = a(mol) ; n MgO = b(mol) ; n Fe2O3 = c(mol)
=> 80a + 40b + 160c = 12(1)
CuO + 2HCl $\to$ CuCl2 + H2O
MgO + 2HCl $\to$ MgCl2 + H2O
Fe2O3 + 6HCl $\to$ 2FeCl3 + 3H2O
n HCl = 2a + 2b + 6c = 0,225.2 = 0,45(2)
Thí nghiệm 2 :
$CuO + CO \xrightarrow{t^o} Cu + H_2O$
$Fe_2O_3 + 3CO \xrightarrow{t^o} 2Fe + 3CO_2$
m chất rắn = 64a + 40b + 56.2c = 10(2)
Từ (1)(2)(3) suy ra a = 0,05 ; b = 0,1 ; c = 0,025
%m CuO = 0,05.80/12 .100% = 33,33%
%m MgO = 0,1.40/12 .100% = 33,33%
%m Fe2O3 = 33,34%
b)
n BaCO3 = 14,775/197 = 0,075(mol) > n CO2 = n CuO + 3n Fe2O3 = 0,125
Do đó, kết tủa bị hòa tan một phần
Ba(OH)2 + CO2 → BaCO3 + H2O
0,075........0,075.......0,075.............(mol)
Ba(OH)2 + 2CO2 → Ba(HCO3)2
0,025..........0,05..............................(mol)
=> n Ba(OH)2 = 0,075 + 0,025 = 0,1(mol)
=> CM Ba(OH)2 = 0,1/0,5 = 0,2M

Số mol của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{7,168}{22,4}=0,32\left(mol\right)\)
Pt : 2Al + 3H2SO4 → Al2(SO4)3 + 3H2\(|\)
2 3 1 3
a 0,32
Mg + H2SO4 → MgSO4 + H2\(|\)
1 1 1 1
b 0,32
Gọi a là số mol của Al
b là số mol của Mg
Theo đề ta có : mAl Mg+ m = 6,6 (g)
⇒ nAl . MAl + nMg . MMg = 6,6 g
27a + 24b = 6,6g (1)
Theo phương trình : 3a + 1b = 0,32 (2)
Từ (1),(2), ta có hệ phương trình :
27a + 24b = 6,6
3a + 1b = 0,32
⇒ \(\left\{{}\begin{matrix}a=0,024\\b=0,248\end{matrix}\right.\)
Khối lượng của nhôm
mAl = nAl . MAl
= 0,024 .27
= 0,648 (g)
Khối lượng của magie
mMg = nMg . MMg
= 0,248 . 24
= 5,952 (g)
Pt : H2 + CuO → (to) Cu + H2O\(|\)
1 1 1 1
0,32 0,32
Số mol của đồng
nCu = \(\dfrac{0,32.1}{1}=0,32\left(mol\right)\)
Khối lượng của đồng
mCu = nCu . MCu
= 0,32 . 64
= 20,48 (mol)
Chúc bạn học tốt

a, Ta có: $n_{O}=0,6(mol)$
Suy ra $n_{H^+/pu}=1,2(mol)\Rightarrow n_{H_2SO_4}=0,6(mol)$
Bảo toàn khối lượng ta có: $m_{muoi}=29,6+0,6.96=87,2(g)$

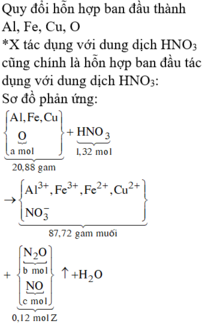
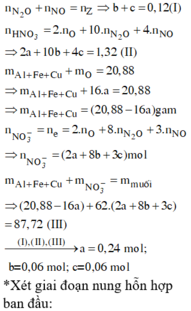
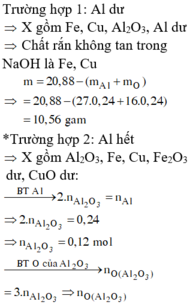
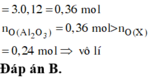

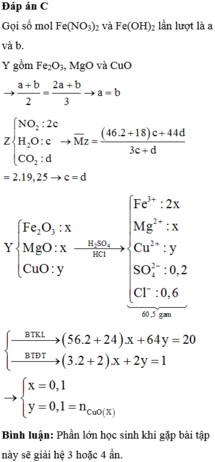
a)
Fe2O3 phản ứng trước CuO
Fe2O3+3H2SO4-->Fe2(SO4)3+3H2O
0,1______0,3
nFe2O3=0,1-->nH2SO4=0,3mol
nH2SO4 bđ=0,155.2=0,31mol
-->nH2SO4 dư=0,01mol
H2SO4+CuO-->CuSO4+H2O
0,01____0,01
nCuO bđ=0,16mol
-->nCuO chưa tan=0,15mol
-->m=0,15.80=12g
b)
mH2SO4 = 420.40% = 168g
CuO phản ứng hết nên ta có :
CuO + H2SO4 = CuSO4 + H2O
80.........98...........160 (g)
a...........98a/80.....160a/80 (g)
=> mH2SO4 (dư) = 168 - 98a/80 = 168 - 1,225a (g)
mdd (sau ph.ư) = mCuO + mddH2SO4 = a + 420 (g)
C%H2SO4 (dư) = 14% => (168 - 1,225a)/(a + 420) = 14/100 => a = 80
mdd (sau ph.ư) = a + 420 = 80 + 420 = 500g
mCuSO4 = 160a/80 = 160.80/80 = 160g
=> C%CuSO4 = C = 160/500 = 32%
c)
PTHH:M+2HCl->MCl2+H2(khí)
mHCl=(200*7.3)/100=14.6(g)
nHCl=14.6:36.5=0.04(mol)
theo pthh:nH2=1/2 nHCl
-> nH2=1/2*0,4=0,2(mol)
mH2=0,2*2=0,4(g)
theo pthh:nM=1/2 nHCl
->nM=1/2*0,4=0,2(mol)
a=0,2*MM(MM là khối lượng mol của M)
Ta có mdd sau phản ứng:0,2MM+200-0,4=0,2MM+199,6
mMCl2=0,2(MM+36,5*2)=0,2(MM+71)=0,2MM+1...
C% dd sau p/ứ:(0,2MM+14,2)/(0,2MM+199,6)=12,05/100
nhân chéo lên bạn sẽ có: 20MM+1420=2,41MM+2405,18
17,6MM=985.18
MM xấp xỉ 56(g/mol)
-> M là Fe
a=0.2*56=11.2(g)
Nguồn: sưu tầm