Bài 1: Hỗn hợp A gồm Fe và Cu. Cho 10,24 gam hỗn hợp A vào dung dịch HCl dùng dư, thấy tạo thành 1,792 lít khí H2 (đktc). Tính phần trăm khối lượng từng chất trong hỗn hợp A.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(Fe+2HCl \to FeCl_2+H_2\\\ n_{H_2}=\frac{1,792}{22,4}=0,08(mol)\\ n_{H_2}=0,08(mol)\\ \%m_{Fe}=\frac{0,08.56}{10,24}.100=43,75\%\\ \%_{Cu}=100-43,75=56,25\%\)

2Al + 6HCl → 2 A l C l 3 + 3 H 2
a……….3/2.a (mol)
Mg + 2HCl → M g C l 2 + H 2
b....................b (mol)
4 gam rắn không tan là Cu, gọi số mol của Al và Mg lần lượt là a và b (mol). Ta có:
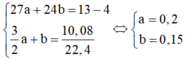
⇒ % m C u = 4 13 .100 = 30,77 % ⇒ % m A l = 0,2.27 13 .100 = 41,54 % ⇒ % m M g = 100 % − 30,77 % − 41,54 % = 27,69 %
⇒ Chọn C.

Chú ý: Mỗi lần hỏi bạn up lên từng câu hỏi thôi, không nên đưa một lúc nhiều câu hỏi trong 1 lần hỏi, vì như thế chỉ có 1 câu được trả lời thôi nhé.
HD:
Bài 1.
Vì Cu đứng sau H trong dãy các kim loại nên Cu không phản ứng với HCl.
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
0,075 mol
Theo phản ứng trên, số mol Fe = số mol H2 = 0,075 mol. Suy ra khối lượng Fe = 56.0,075 = 4,2 g.
Khối lượng Cu = 8 - 4,2 = 3,8 g. Từ đó, %Fe = 4,2.100/8 = 52,5%; %Cu = 100 - 52,5 = 47,5%.

Ta có nH2 = 3,36/22,4 = 0,15 mol
Fe +2 HCl -> FeCl2 + H2
0,15. 0,3 <-. 0,15. ( Mol)
=> mFe = 0,15 × 56 = 8,4g
=> %Fe = 8,4/15×100% = 56%
=> %Cu = 100% - 56% = 44%
=>VHCl =1\0,3=10\3 l

Câu 1 :
\(n_{H2}=\dfrac{5,04}{22,4}=0,225\left(mol\right)\)
Pt : \(2Al+6HCl\rightarrow2AlCl_3+3H_2|\)
2 6 2 3
a 0,15 1,5a
\(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
b 0,3 1b
a) Gọi a là số mol của Al
b là số mol của Zn
\(m_{Al}+m_{Zn}=11,1\left(g\right)\)
⇒ \(n_{Al}.M_{Al}+n_{Zn}.M_{Zn}=11,1g\)
⇒ 27a + 65b = 11,1g(1)
Theo phương trình : 1,5a + 1b = 0,225(2)
Từ(1),(2), ta có hệ phương trình :
27a + 65b = 11,1g
1,5a + 1b = 0,225
⇒ \(\left\{{}\begin{matrix}a=0,05\\b=0,15\end{matrix}\right.\)
\(m_{Al}=0,05.27=1,35\left(g\right)\)
\(m_{Zn}=0,15.65=9,75\left(g\right)\)
0/0Al = \(\dfrac{1,35.100}{11,1}=12,16\)0/0
0/0Zn = \(\dfrac{9,75.100}{11,1}=87,84\)0/0
b) \(n_{HCl\left(tổng\right)}=0,15+0,3=0,45\left(mol\right)\)
\(V_{ddHCl}=\dfrac{0,45}{1}=0,45\left(l\right)\)
Chúc bạn học tốt
Câu 2 :
\(n_{H2}=\dfrac{1,456}{22,4}=0,065\left(mol\right)\)
Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
a 0,1 1a
\(2Al+6HCl\rightarrow2AlCl_3+3H_2|\)
2 6 2 3
b 0,03 1,5b
a) Gọi a là số mol của Fe
b là số mol của Al
\(m_{Fe}+m_{Al}=3,07\left(g\right)\)
⇒ \(n_{Fe}.M_{Fe}+n_{Al}.M_{Al}=3,07g\)
⇒ 56a + 27b = 3,07g(1)
Theo phương trình : 1a + 1,5b = 0,065(2)
Từ(1),(2),ta có hệ phương trình :
56a + 27b = 3,07g
1a + 1,5b = 0,065
⇒ \(\left\{{}\begin{matrix}a=0,05\\b=0,01\end{matrix}\right.\)
\(m_{Fe}=0,05.56=2,8\left(g\right)\)
\(m_{Al}=0,01.27=0,27\left(g\right)\)
0/0Fe = \(\dfrac{2,8.100}{3,07}=91,21\)0/0
0/0Al = \(\dfrac{0,27.100}{3,07}=8,79\)0/0
b) \(n_{HCl\left(tổng\right)}=0,1+0,03=0,13\left(mol\right)\)
\(m_{HCl}=0,13.36,5=4,745\left(g\right)\)
\(m_{ddHCl}=\dfrac{4,745.100}{10}=47.45\left(g\right)\)
Chúc bạn học tốt

\(n_{H_2}=\dfrac{0,784}{22,4}=0,035\left(mol\right)\\ Đặt:n_{Al}=a\left(mol\right);n_{Fe}=b\left(mol\right)\left(a,b>0\right)\\ PTHH:2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ \Rightarrow\left\{{}\begin{matrix}27a+56b=1,39\\1,5a+b=0,035\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,01\\b=0,02\end{matrix}\right.\\ \Rightarrow\%m_{Al}=\dfrac{0,01.27}{1,39}.100=37,53\%\\ \Rightarrow\%m_{Fe}=100\%-37,53\%=62,47\%\)

Bài 1:
a+b) PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)=n_{Fe}\)
\(\Rightarrow m_{Fe}=0,2\cdot56=11,2\left(g\right)\) \(\Rightarrow m_{Cu}=6,4\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{11,2}{17,6}\cdot100\%\approx63,64\%\\\%m_{Cu}=36,36\%\end{matrix}\right.\)
c) Ta có: \(n_{Cu}=\dfrac{6,4}{64}=0,1\left(mol\right)\)
Bảo toàn nguyên tố: \(n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Fe}=0,1\left(mol\right)=n_{CuSO_4}\)
\(\Rightarrow m_{muối}=0,1\cdot400+0,1\cdot160=56\left(g\right)\)
Bài 2:
Quy đổi hh gồm Fe (a mol) và O (b mol)
\(\Rightarrow56a+16b=27,6\) (1)
Ta có: \(n_{SO_2}=\dfrac{5,04}{22,4}=0,225\left(mol\right)\)
Bảo toàn electron: \(3n_{Fe}=2n_O+2n_{SO_2}\) \(\Rightarrow3a-2b=0,45\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,39\\b=0,36\end{matrix}\right.\)
Bảo toàn nguyên tố: \(n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Fe}=0,195\left(mol\right)\) \(\Rightarrow m_{Fe_2\left(SO_4\right)_3}=0,195\cdot400=78\left(g\right)\)
Fe+2HCl->FeCl2+H2
=>nFe=nH2=1,792/22,4=0,08mol
=>mFe=0,08.56=4,48=>C%Fe\(=\dfrac{4,48}{10,24}.100\%=43,75\%\)
=>C%Cu=100%-43,75%=56,25%
Em cảm ơn ạ