Nhúng thanh Mg vào dung dịch chứa 0,1 mol muối sunfat trung hoà của một kim loại R, sau phản ứng hoàn toàn lấy thanh Mg ra thấy khối lượng thanh Mg tăng 4,0 gam. Số muối của kim loại R thoả mãn là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


TH1: Nếu M có hóa trị II
ta có Mg + MSO4 → MgSO4 + M
=> m tăng = mM – mMg => 0,1M -2,4 = 4 => M=64 (Cu)
TH2: Nếu M có hóa trị khác II
ta có xMg + M2(SO4)x →x MgSO4 + 2M
=> m tăng = 0,2M – 2,4x = 4 + Nếu x=1
=> M = 32 (loại) + Nếu x=3 => M = 56 (Fe)
TH3: nếu M có hóa trị IV
=> tạo muối M(SO4)2 m tăng = 0,1M – 4,8 = 4
=> M= 88 (loại) Chỉ có 2 kim loại thỏa mãn =>D

Giải thích: Đáp án A
Với 0,1 mol sẽ tăng 0,1 . ( MM – MMg ) = 4
=> MM = 24 + 40 = 64 => là Cu
=> Ngoài muối CuSO4 còn có thể là CuCl2 , Cu(NO3)2 (các muối tan của đồng)
(Bản chất của phản ứng là kim loại mạnh đẩy kim loại yếu ra khỏi dung dịch muối, còn gốc muối gì cũng được miễn là phải tan trong nước)

Muối sunfat có thể mang hóa trị 1, 2 hoặc 3.
Xét lần lượt 3 trường hợp:
TH1: muối sunfat hóa tri II
Mg + XSO4 -> MgSO4 + X2+
0,1 0,1 0,1
Khối lượng tăng lên là 4 gam nên MX = 4 : 0,1 + 24 = 64 => Cu => Thỏa mãn
TH2: muối sunfat hóa tri I:
Mg + XSO4 -> MgSO4 + 2X+
0,1 0,2
=>MX = 4 : 0,2 + 24 = 44 => không thỏa mãn
Tương tự TH muối sunfat hóa tri III, không có kim loại thỏa mãn => Đáp án D

Đáp án B
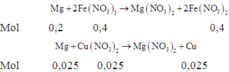
Nếu Cu(NO3)2 phản ứng hết như phản ứng trên thì
![]()
Do đó tiếp tục xảy ra phản ứng:
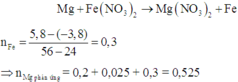
Vậy mMg phản ứng = 12,6 (gam)

Đáp án : D
Mg + 2Fe3+ -> Mg2+ + 2Fe2+
0,4 0,8 mol
Mg + Cu2+ -> Mg2+ + Cu
0,05 0,05 mol
Mg + Fe2+ -> Mg2+ + Fe
x x
(Giả sử có cả 3 phản ứng trên)
mKl tăng = 56.x + 0,05.64 – 24.(0,05 + x) – 0,4.24 = 11,6g
=> x = 0,6 mol < 0,8 (TM)
=> mMg pứ = 24.(0,05 + 0,6 + 0,4) = 25,2g


$nMg + R_2(SO_4)_n \to nMgSO_4 + 2R$
Theo PTHH :
$n_R = 0,2(mol)$
$n_{Mg} = 0,1n(mol)$
Suy ra: $0,2.R - 0,1n.24 = 4$
$\Rightarrow R - 12n = 20$
Với n = 1 thì R = 32(loại)
Với n = 2 thì R = 44(loại)
Với n = 3 thì R = 56(Fe)
\(\text{TH1: Muối hoá trị 2}\\ Mg+RSO_4 \to MgSO_4+R\\ n_{Mg}=n_R=0,1(mol)\\ m_{tăng}=0,1.M_R+24.0,1=4\\ \Rightarrow M_r=64(Cu) \text{TH1: Muối hoá trị 3}\\ nMg+R_2(SO_4)_n \to nMgSO_4+2R\\ n_{Mg}=\frac{0,2}{n}(mol)\\ m_{tăng}=0,2.M_R+24.0,1.n=4\\ n=3; R=56 (Fe) \)