Bài 2 Cho 12g Fe và 10g dung dịch chứa Axit clohidric .Tìm khối lượng sao phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu 1:
Khi đốt khí H2 trong O2 thì:
\(PTHH: 2H2+O2-t^o->2H2O\)
Ta có : \(nH2 (đktc) = \dfrac{11,2}{22,4} = 0,5 (mol)\)
Theo PTHH: nO2 cần dùng = \(\dfrac{1}{2}.nH2 = 0,25 (mol)\)
Vậy thể tích khí O2 cần dùng (đktc) là:
\(V_O2 = nO2.22,4 = 0,25.22,4 =5.6 (l)\)
Bài 3: Các phương trình hóa học xảy ra:
\(CuO + H2-t^o-> Cu+H2O\)
\(ZnO + H2-t^o->Zn + H2O\)
\(Fe2O3+3H2-t^o-> 2Fe+3H2O\)
\(PbO +H2-t^o->Pb+H2O\)
\(Fe3O4+4H2(dư)-t^o->3Fe+4H2O\)
\(Ag_2O+H_2-t^o-2Ag +H_2O\)

Đáp án B
Zn có tính khử mạnh hơn Fe, Zn sẽ phản ứng với dung dịch CuSO4 trước.
Theo đề: hỗn hợp rắn Z phản ứng với dung dịch H2SO4 loãng thu được 1 muối duy nhất → trong hỗn hợp rắn Z có Cu và Fe dư. Vậy mFe dư = 0,28 (g) và mCu = 2,84 - 0,28 = 2,56 (g)
Ta có: khối lượng hỗn hợp X phản ứng với Cu2+ = 2,7 - 0,28 = 2,42 (g)
Gọi nZn = x mol; nFe pư = y mol
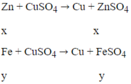
Ta có hệ:
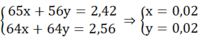
mFe ban đầu = 0,02.56 + 0,28 = 1,4 (g)
![]()

Đáp án B
Ta có:
![]()
mCu = 0,7m (g)
Vì Fe phản ứng trước Cu và sau khi phản ứng còn 0,75m (g) chất rắn → Cu chưa phản ứng 0,7m
Fe dư 0,75m - 0,7m = 0,05m → mFe pư = 0,2m - 0,05m = 0,25m (g)
Fe dư → Chỉ tạo muối Fe(NO3)2
HNO3 hết (Lưu ý chỉ H+ hết, NO3- còn trong muối).
Quá trình nhường electron:

Quá trình nhận electron:
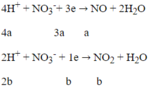
Áp dụng định luật bảo toàn electron:
![]()
→ m = 50,4

a) $n_{H_2SO_4} = \dfrac{44,1}{98} = 0,45(mol)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
Theo PTHH :
$n_{Al} = \dfrac{2}{3}n_{H_2SO_4} = 0,3(mol)$
$m_{Al} = 0,3.27 = 8,1(gam)$
b) $n_{H_2} = n_{H_2SO_4} = 0,45(mol)$
$\Rightarrow V_{H_2} = 0,45.22,4 =1 0,08(lít)$
c)
Cách 1 : $n_{Al_2(SO_4)_3} = \dfrac{1}{3}n_{H_2SO_4} = 0,15(mol)$
$\Rightarrow m_{Al_2(SO_4)_3} = 0,15.342 = 51,3(gam)$
Cách 2 : Bảo toàn khối lượng, $m_{Al_2(SO_4)_3} = 8,1 + 44,1 - 0,45.2 = 51,3(gam)$

Đáp án D
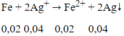
⇒ nAg+ dư = 0,045 - 0,04 = 0,005 mol. Khi đó xảy ra phản ứng:
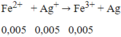
⇒ mAg = (0,04 + 0,005).108 = 4,86g