đốt cháy hoàn toàn 1,4g hỗn hợp cacbon và lưu huỳnh thì cần 1,68 lít khí Oxi ( đktc ) . tính phần trăm khối lượng mỗi chất trong hỗn hợp
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi số mol C, S là a, b
=> 12a + 32b = 7,68
PTHH: C + O2 --to--> CO2
_____a--------------->a
S + O2 --to--> SO2
b--------------->b
=> a + b = \(\dfrac{9,856}{22,4}=0,44\)
=> a = 0,32; b = 0,12
=> \(\left\{{}\begin{matrix}\%C=\dfrac{0,32.12}{7,68}.100\%=50\%\\\%S=\dfrac{0,12.32}{7,68}.100\%=50\%\end{matrix}\right.\)

a: \(C+O_2\rightarrow CO_2\)(ĐK: t độ)
x x x
\(S+O_2\rightarrow SO_2\)(ĐK: t độ)
y y y
b: \(n_{O_2}=\dfrac{11.2}{22.4}=0.5\left(mol\right)\)
Theo đề, ta có hệ:
12x+32y=10 và x+y=0,5
=>x=0,3 và y=0,2
\(m_C=0.3\cdot12=3.6\left(g\right)\)
\(m_S=0.2\cdot32=6.4\left(g\right)\)
c: \(n_{CO_2}=n_C=0.3\left(mol\right)\)
\(n_{SO_2}=n_S=0.2\left(mol\right)\)
\(V_{khí}=22.4\left(0.3+0.2\right)=11.2\left(lít\right)\)
\(n_{O_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH :
\(C+O_2\rightarrow\left(t^o\right)CO_2\)
x x x
\(S+O_2\rightarrow\left(t^o\right)SO_2\)
y y y
Gọi n C = x
n S = y (mol)
Ta có hệ PT :
\(\left\{{}\begin{matrix}12x+32y=10\\x+y=0,5\end{matrix}\right.\)
\(\rightarrow x=0,3;y=0,2\)
\(m_C=0,3.12=3,6\left(g\right)\)
\(m_S=0,2.32=6,4\left(g\right)\)
\(c,V_{hhk}=\left(0,3+0,2\right).22,4=11,2\left(l\right)\)

Gọi: \(\left\{{}\begin{matrix}n_{CO}=x\left(mol\right)\\n_{H_2}=y\left(mol\right)\end{matrix}\right.\)
⇒ 28x + 2y = 11,8 (1)
PT: \(2CO+O_2\underrightarrow{t^o}2CO_2\)
\(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Ta có: \(n_{O_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{CO}+\dfrac{1}{2}n_{H_2}=\dfrac{1}{2}x+\dfrac{1}{2}y\left(mol\right)\)
⇒ x + y = 0,7 (2)
Từ (1) và (2) ⇒ x = 0,4 (mol), y = 0,3 (mol)
a, \(\left\{{}\begin{matrix}\%m_{CO}=\dfrac{0,4.28}{11,8}.100\%\approx94,9\%\\\%m_{H_2}\approx5,1\%\end{matrix}\right.\)
b, Ở cùng điều kiện nhiệt độ và áp suất, % số mol cũng là % thể tích.
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CO}=\dfrac{0,4}{0,7}.100\%\approx57,14\%\\\%V_{H_2}\approx42,86\%\end{matrix}\right.\)
Bạn tham khảo nhé!
PTHH:
\(2CO+O_2\overset{t^o}{--->}2CO_2\left(1\right)\)
\(2H_2+O_2\overset{t^o}{--->}2H_2O\left(2\right)\)
Ta có: \(n_{O_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
Gọi x, y lần lượt là số mol của CO và H2
a. Theo PT(1): \(n_{O_2}=\dfrac{1}{2}.n_{CO}=\dfrac{1}{2}x\left(mol\right)\)
Theo PT(2): \(n_{O_2}=\dfrac{1}{2}.n_{H_2}=\dfrac{1}{2}y\left(mol\right)\)
\(\Rightarrow\dfrac{1}{2}x+\dfrac{1}{2}y=0,35\) (*)
Theo đề, ta có: \(28x+2y=11,8\) (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}\dfrac{1}{2}x+\dfrac{1}{2}y=0,35\\28x+2y=11,8\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,4\\y=0,3\end{matrix}\right.\)
\(\Rightarrow m_{H_2}=2.0,3=0,6\left(g\right)\)
\(\Rightarrow\%_{m_{H_2}}=\dfrac{0,6}{11,8}.100\%=5,08\%\)
\(\%_{m_{CO}}=100\%-5,08\%=94,92\%\)
b. \(\%_{V_{CO}}=\dfrac{0,4}{0,4+0,3}.100\%=57,1\%\)
\(\%_{V_{H_2}}=100\%-57,1\%=42,9\%\)

a, \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(2C_2H_2+5O_2\underrightarrow{t^o}4CO_2+2H_2O\)
Ta có: \(n_{CH_4}+n_{C_2H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\left(1\right)\)
\(n_{CO_2}=n_{CH_4}+2n_{C_2H_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CH_4}=0,25\left(mol\right)\\n_{C_2H_2}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,25.22,4}{6,72}.100\%\approx83,33\%\\\%V_{C_2H_2}\approx16,67\%\end{matrix}\right.\)
Theo PT: \(n_{O_2}=2n_{CH_4}+\dfrac{5}{2}n_{C_2H_2}=0,625\left(mol\right)\Rightarrow m_{O_2}=0,625.32=20\left(g\right)\)



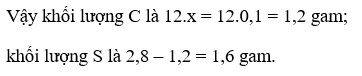

\(C\left(x\right)+O_2\left(x\right)\rightarrow CO_2\)
\(S\left(y\right)+O_2\left(y\right)\rightarrow SO_2\)
Gọi số mol C,S lần lược là x, y
\(\Rightarrow12x+32y=1,4\left(1\right)\)
\(n_{O_2}=\frac{1,68}{22,4}=0,075\)
\(\Rightarrow x+y=0,075\left(2\right)\)
Từ (1) và (2) ta có hệ pt: \(\left\{\begin{matrix}12x+32y=1,4\\x+y=0,075\end{matrix}\right.\)
\(\Leftrightarrow\left\{\begin{matrix}x=0,05\\y=0,025\end{matrix}\right.\)
\(\Rightarrow m_C=0,05.12=0,6\)
\(\Rightarrow\%C=\frac{0,6}{1,4}.100\%=42,86\%\)
\(\Rightarrow\%S=100\%-42,86\%=57,14\%\)