những hợp chất nào sau đây có thế dùng để điều chế khí Oxi trong phòng thí nghiệm : KMnO4 , KClO3 , KNO3 , HgO . tính thể tích khí O2 thu được ở đktc khi phân hủy
a , 0,5 mol mỗi chất trên
b , 50 g mỗi chất KNO3 hoặc HgO
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.5__________________________0.25
VO2 = 0.25*22.4 = 5.6 (l)
2KClO3 -to-> 2KCl + 3O2
0.5_______________0.75
VO2 = 0.75*22.4 = 16.8 (l)
2KNO3 -to-> 2KNO2 + O2
0.5________________0.25
VO2 = 0.25*22.4 = 5.6 (l)
2HgO -to-> 2Hg + O2
0.5____________0.25
VO2 = 0.25*22.4 = 5.6 (l)
b)
nKNO3 = 50/101 (mol)
2KNO3 -to-> 2KNO2 + O2
50/101______________25/101
VO2 = 25/101 * 22.4 = 5.54 (l)
nHgO = 50/217 (mol)
2HgO -to-> 2Hg + O2
50/217 _________25/217
VO2 = 2.58 (l)

a.\(n_{KClO_3}=\dfrac{m_{KClO_3}}{M_{KClO_3}}=\dfrac{12,25}{122,5}=0,1mol\)
\(2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\)
2 2 3 ( mol )
0,1 0,15
\(V_{O_2}=n_{O_2}.22,4=0,15.22,4=3,36l\)
b.\(V_{kk}=V_{O_2}.5=3,36.5=16,8l\)
c.\(n_{Fe}=\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{28}{56}=0,5mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
3 2 1 ( mol )
0,5 > 0,15 ( mol )
0,225 0,15 ( mol )
\(m_{Fe\left(du\right)}=n_{Fe\left(du\right)}.M_{Fe}=\left(0,5-0,225\right).56=15,4g\)

nO2 = 3,36/22,4 = 0,15 (mol)
PTHH:
2KClO3 -> (t°) 2KCl + O2
0,1 <------------------------ 0,15
2KNO3 -> (t°) 2KNO2 + O2
0,3 <--------------------------- 0,15
2HgO -> (t°) 2Hg + O2
0,3 <---------------------- 0,15
So sánh: 0,1 < 0,3 = 0,3
=> Dùng KClO3 thì sẽ tiết kiệm nhất
PTHH
2KClO3 -to-> 2KCl + 3O2
0,1--------------------------0,15
2KNO3 -to-> 2KNO2 + O2
0,3-----------------------------0,15
2HgO -to-> 2Hg + O2
0,3---------------------0,15
ta cho mỗi khí ở ccas pt là như nhau
n O2=\(\dfrac{3,36}{22,4}\)=0,15 mol
=> ta suy ra khối lg thấy KClO3 là tiết kiệm nhất

a) Các phương trình phản ứng
2KNO3 2KNO2 + O2↑ (1)
2KClO3 2KCl + 3O2↑ (2)
b) Theo (1) và (2), thấy số mol hai muối tham gia phản ứng như nhau nhưng số mol oxi tạo thành khác nhau và do đó thể tích khí oxi thu được là khác nhau.
Theo (1): nO2 = nKNO3 =
= 0,05 mol; VO2 = 0,05x22,4 = 1,12 lít
Theo (2): nO2 = nKClO3 =
= 0,15 mol; VO2 = 0,15x22,4 = 3,36 lít
c) Để thu được 1,12 lít khí (0,05 mol) O2, thì:
Theo (1): nKNO3 = 2nO2 = = 0,1 mol; mKNO3 = 0,1x101 = 10,1 g
Theo (2): nKClO3 = nO2 =
x0,05 mol; VKClO3 =
x0,05x122,5 = 4,086 g.

Câu 18: Những chất được dùng để điều chế oxi trong phòng thí nghiệm là: |
A. KClO3 và CaCO3
B. KMnO4 và H2O |
C. KMnO4 và không khí
D. KClO3 và KMnO4
Câu 19: Điều khẳng định nào sau đây là đúng ? Không khí là :
A. Một hỗn hợp.
B. Một hợp chất.
C.Một đơn chất.
D. Một chất tinh khiết.
Câu 20: Chỉ ra tên gọi đúng của hợp chất Al2O3
A. Sắt oxit.
B. Sắt (III) oxit.
C. Nhôm oxit.
D. Nhôm (III) oxit.
Câu 21: Chỉ ra công thức của oxit viết sai
A. Mg0.
B. P205.
C. FeO2.
D. ZnO.
Câu 22: Phản ứng hóa học không xảy ra sự oxi hóa là: A. 4NH3 + 502 → 4NO + 6H2O
B. O2 + 2H2 → 2H2O C. Ca + O2 + CaO
D. NaOH + HCl → NaCl + H2O
Câu 23: Khi nhiệt phân 49 g kali clorat (KClO3). Thể tích khí oxi sinh ra (ở đktc) là :
A. 3,361.
B. 6,721.
C. 13,441.
D. 22,41.
Câu 24: Khí Oxi hóa lỏng ở nhiệt độ nào sau đây:
A. Ở -183 °C
B. Ở -196 °C
C. Ở 183 °C
D. Ở 196°C II.
mình cần giải cái câu này
Câu 2: (3 đ) a. Tính thể tích khí oxi thu được (ở đktc) khi nhiệt phân hoàn toàn 47,4 gam KMnO4 .
b. Nếu dùng 6,75 gam nhôm cho tác dụng với lượng oxi thu được ở phản ứng trên thì khi phản | ứng kết thúc chất nào còn dư? Khối lượng dư là bao nhiêu gam?
Câu 3:(2,0 điểm) Có 3 bình không nhãn chứa các khí sau: O, N, CO2. Bằng phương pháp hóa học em hãy nhận biết các khí trên?
Câu 4: (3,0 điểm)
Đốt cháy hoàn toàn 126 g sắt trong bình chứa khí O2. a. Tính thể tích khí O2 (ở đktc) đã tham gia phản ứng trên. b. Tính khối lượng KClOg cần dùng để khi phân huỷ thì thu được một thể tích khí O2 (ởđktc) bằng với thể tích khí 0 đã sử dụng ở phản ứng trên.

Dùng KClO3
PTHH: \(2KClO_3\xrightarrow[MnO_2]{t^o}2KCl+3O_2\uparrow\)
Ta có: \(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\) \(\Rightarrow n_{KClO_3}=\dfrac{2}{15}\left(mol\right)\)
\(\Rightarrow m_{KClO_3}=\dfrac{2}{15}\cdot122,5\approx16,33\left(g\right)\)

\(n_{O_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
0,3<------------------------------0,15
2KClO3 --to--> 2KCl + 3O2
0,1<-----------------0,15
=> \(\left\{{}\begin{matrix}m_{KMnO_4}=0,3.158=47,4\left(g\right)\\m_{KClO_3}=0,1.122,5=12,25\left(g\right)\end{matrix}\right.\)
=> Dùng KClO3 sẽ cần khối lượng nhỏ hơn

Chọn đáp án: b) KClO3. c) KMnO4.
2KClO3 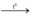 2KCl + 3O2
2KCl + 3O2
2KMnO4 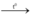 K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2

a) $2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2$
b) n KMnO4 = 15,8/158 = 0,1(mol)
Theo PTHH : n O2 = 1/2 n KMnO4 = 0,05(mol)
=> V O2 = 0,05.22,4 = 1,12(lít)
c)
$3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4$
Theo PTHH : n Fe = 3/2 nO2 = 0,075(mol)
=> m Fe = 0,075.56 = 4,2(gam)
Trong 4 hợp chất kể trên có 2 hợp chất sử dụng để điều chế khi oxi trong phòng thí nghiệm rất thông dụng: KMnO4 (kali pemaganat) và KClO3 (kali clorat). Ngoài ra các chất phản ứng có thể tạo thành các chất tạo thành có khí oxi thì đó cũng là một cách điều chế khi oxi (nhưng ít thông dụng).
a) PTHH: 2KMnO4 -to-> K2MnO4 + MnO2 + O2 (1)
2KClO3 -to-> 2KCl + 3O2 (2)
2KNO3 -to-> 2KNO2 + O2 (3)
2HgO -to-> 2Hg + O2 (4)
- Phương trình (1):
Theo PTHH và đề bài, ta có:
\(n_{O_2}=\frac{n_{KMnO_4}}{2}=\frac{0,5}{2}=0,25\left(mol\right)\)
=> \(V_{O_2\left(đktc\right)}=0,25.22,4=5,6\left(l\right)\)
- Phương trình (2):
Theo PTHH và đề bài, ta có:
\(n_{O_2}=\frac{3.n_{KClO_3}}{2}=\frac{3.0,5}{2}=0,75\left(mol\right)\)
=> \(V_{O_2\left(đktc\right)}=0,75.22,4=16,8\left(l\right)\)
- Phương trình (3):
Theo PTHH và đề bài, ta có:
\(n_{O_2}=\frac{n_{KNO_3}}{2}=\frac{0,5}{2}=0,25\left(mol\right)\)
=> \(V_{O_2\left(đktc\right)}=22,4.0,25=5,6\left(l\right)\)
- Phương trình (4):
Theo PTHH và đề bài, ta có:
\(n_{O_2}=\frac{n_{HgO}}{2}=\frac{0,5}{2}=0,25\left(mol\right)\)
=> \(V_{O_2\left(đktc\right)}=0,25.22,4=5,6\left(l\right)\)
b)Đối với 50 g KNO3
\(n_{KNO_3}=\frac{50}{101}\approx0,495\left(mol\right)\)
Theo PTHH và đề bài, ta có:
\(n_{O_2}=\frac{n_{KNO_3}}{2}=\frac{0,495}{2}=0,2475\left(mol\right)\)
=> \(V_{O_2\left(đktc\right)}=0,2475.22,4=5,544\left(l\right)\)
- Đối với 50g HgO
\(n_{HgO}=\frac{50}{217}\approx0,23\left(mol\right)\)
=> \(n_{O_2}=\frac{n_{HgO}}{2}=\frac{0,23}{2}=0,115\left(mol\right)\)
=> \(V_{O_2\left(đktc\right)}=22,4.0,115=2,576\left(l\right)\)