Cho 7,8 gam hỗn hợp 2 kim loại Al, Mg vào HCl loãng dư. Phản ứng kết thúc thu được V lít H2(đktc) và dung dịch chứa 36,2 gam muối.Tính giá trị của V?
A. 8,96l.
B. 6,72l.
C. 8,4l.
D. 2,24l.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi \(n_{Al}=x\left(mol\right)\\ n_{Mg}=y\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\\ Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
\(n_{AlCl_3}=n_{Al}=x\left(mol\right)\\ n_{MgCl_2}=n_{Mg}=y\left(mol\right)\)
Ta có \(\left\{{}\begin{matrix}27x+24y=7,8\\133,5x+95y=36,2\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
\(n_{H_2}=n_{Al}+n_{Mg}=0,2+0,1=0,3\left(mol\right)\\ V_{H_2\left(ĐKTC\right)}=0,3.22,4=6,72\left(l\right)\)
Chọn B.

Đáp án D
Nhận thấy ở hai thí nghiệm có lượng kim loại tham gia phản ứng như nhau, lượng HCl sử dụng lớn hơn lượng HCl sử dụng ở thí nghiệm 1 nhưng lượng H2 ở hai thí nghiệm thu được như nhau.
Do đó ở thí nghiệm 2 HCl phản ứng dư, thí nghiệm 1 có HCl phản ứng đủ hoặc dư.
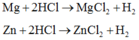
Có
![]()
Quan sát 4 đáp án nhận thấy chỉ có giá trị 0,3 là phù hợp.

Ta có: \(m_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\) \(\Rightarrow m_{H_2}=0,2\cdot2=0,4\left(g\right)\)
\(\Rightarrow m_{dd\left(sau.pư\right)}=m_{hh}+m_{ddH_2SO_4}-m_{H_2}=309,6\left(g\right)\)
\(\Rightarrow a=309,6-300=9,6\left(g\right)\)

Đáp án B
Đặt nN2O = nH2 = a (mol)
nNH4+ = b (mol)
=> nH+ = 10nN2O + 2nH2 + 10 nNH4+ = 12a + 10b
=> nNa+ = 12a + 10b + 0,06 ; nSO42- = 12a + 10b
nMg = nMg(OH)2 = 0,24 (mol)
Bảo toàn electron: 2nMg + 3nAl = 8nN2O + 2nH2 + 8nNH4+
=> nAl = (10a + 8b – 0,48)/3
BTNT N => 3nAl(NO3)3 + nNaNO3 = 2n N2O + nNH4+
=> nAl(NO3)3 = (2a + b – 0,06)/3
BTNT Al => nAl3+ trong X = nAl + nAl(NO3) = 4a + 3b – 0,18
Khối lượng muối trong X( Na+ ; Al3+; Mg2+; NH4+ ; SO42- ):
23( 12a + 10b + 0,06) + 27 ( 4a + 3b – 0,18) + 0,24.24 + 18b + 96 ( 12a + 10b) = 115, 28 (1)
nNaOH = 4nAl3+ + 2nMg2+ + nNH4+
=> 0,92 = 4 ( 4a + 3b – 0,18 ) + 2.024 + b (2)
Từ (1) và (2) => a = b = 0,04 (mol)
=> nT = 2a = 0,08 (mol)
=> V= 1,792 (lít)

Các PTHH :
Mg + H 2 SO 4 → Mg SO 4 + H 2 (1)
2Al + 3 H 2 SO 4 → Al 2 SO 4 3 + 3 H 2 (2)
\(2Al+6HCl \rightarrow 2AlCl_3+3H_2\\ Mg+2HCl \rightarrow MgCl_2+H_2\\ n_a=Al\\ n_b=Mg\\ m_{hh}=27a+24b=7,8(1)\\ m_{muối}=133,5a+95b=36,2(2)\\ (1)(2)\\ a=0,2\\ b=0,1\\ n_{H_2}=1,5a+b=1,5.0,2+0,1=0,4mol\\ V_{H_2}=0,4.22,4=8,96l\)