để sản xuất 1 tấn nhôm cần dùng bao nhiêu tấn quặng sắt chứa 85% AlO biết hiệu xuất của quá trình phản ứng là 90%
giúp mjk với sắp thi rồi ,mjk cảm ơn nhiều lắm ạ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Thực tế do một số nguyên nhân, chất tham gia phản ứng không tác dụng hết, nghĩa là hiệu suất dưới 100%. Người ta có thể tính hiệu suất phản ứng như sau :
1. Dựa vào một trong các chất tham gia phản ứng, công thức tính :

2.Dựa vào một trong các chất tạo thành, công thức tính :
2 Al 2 O 3 → 4Al + 3 O 2
Dựa vào phương trình ta có: Cứ 204g Al 2 O 3 thì tạo ra 108g Al
⇒ Để tạo ra 4 tấn Al thì khối lượng Al 2 O 3 cần = 4.204/108 = 7,55g
Hiệu suất phản ứng là 90%, có nghĩa là 7,55 tấn Al 2 O 3 chỉ chiếm 90% khối lượng phải dùng.
Khối lượng oxit phải dùng : 7,55x100/90 = 8,39 tấn
Khối lượng quặng boxit: 8,39x100/40 = 20,972 tấn

2Al2O3--->4Al+3O2
ta có
cứ 204 tấn Al2O3_____108 tấn Al
--> 4 tấn AL cần 7,56 tấn Al2O3
vì hàm lượng quặng chỉ chứa 40% nên lượng quặng ban đầu là 18,9 tấn
H=90%
-->khối lượng quặng cần là 21 tấn

Khối lượng của Al2O3 trong 1 tấn quặng = 48,5%.1000 = 0,485 tấn
2Al2O3 (điện phân nóng chảy )--> 4Al + 3O2
=> mAl = \(\dfrac{0,485.4}{102.2}.27\)= 0,257 tấn
Do hiệu suất phản ứng là 90% => mAl thực tế thu được = 0,257.90% =0,231 tấn
vài trò criolit trong quá trình điện phân là tạo hỗn hợp có nhiệt độ nóng chảy thấp ; làm tăng độ dẫn điện ;tạo xỉ, ngăn nhôm nóng chảy bị oxi hóa trong không khí.

Ta có: mFe = 1000.96% = 960 (kg)
\(\Rightarrow n_{Fe}=\dfrac{960}{56}=\dfrac{120}{7}\left(kmol\right)\)
BTNT Fe: \(n_{Fe_2O_3\left(LT\right)}=\dfrac{1}{2}n_{Fe}=\dfrac{60}{7}\left(kmol\right)\)
\(\Rightarrow m_{Fe_2O_3\left(LT\right)}=\dfrac{60}{7}.160=\dfrac{9600}{7}\left(kg\right)\)
Mà: H = 80%
\(\Rightarrow m_{Fe_2O_3\left(TT\right)}=\dfrac{m_{Fe_2O_3\left(LT\right)}}{80\%}\approx1714,3\left(kg\right)=1,7143\) (tấn)

\(TQ:FeS_2->2SO_2->2SO_3->2H_2SO_4\\ m_{FeS_2}=\dfrac{1\cdot120}{98\cdot2\cdot0,7}=0,8746\left(\text{tấn }\right)\)

Ta có: mFe = 2.90% = 1,8 (tấn) = 1800000 (g)
\(\Rightarrow n_{Fe}=\dfrac{1800000}{56}=\dfrac{225000}{7}\left(mol\right)\)
BTNT Fe, có: nFe2O3 = 1/2nFe = 112500/7 (mol)
\(\Rightarrow m_{Fe_2O_3}=\dfrac{112500}{7}.160=\dfrac{18000000}{7}\left(g\right)=\dfrac{18}{7}\left(tan\right)\)
Vì: H% = 80% ⇒ mFe2O3 (thực tế) = 18/7:80% = 45/14 (tấn)
Mà: Quặng hematit chứa 60% Fe2O3
⇒ mquặng = 45/14:60% ≃ 5,36 (tấn)

\(m_{H_2SO_4}=\dfrac{1000000.98\%}{100\%}=980000(g)\\ \Rightarrow n_{H_2SO_4}=\dfrac{980000}{98}=10000(mol)\\ \Rightarrow n_{FeS_2}=\dfrac{1}{2}n_{H_2SO_4}.80\%=4000(mol)\\ \Rightarrow m_{FeS_2}=4000.120=480000(g)\)

K/lượng của Fe2O3 nguyên chất trong 250 tấn quặng hematit là :
250.60%=150(tấn)
=150000000(g)
Fe2O3+3CO-->2Fe+3CO2
Số mol của Fe2O3 là:
n=m/M=150000000:160
=937500(mol)
Số mol của Fe là:
nFe=2nFe2O3=2.937500
=1875000(mol)
K/lượng của Fe là:
m=n.M=1875000.56
=105000000(g)
K/lượng của Fe nếu hiệu suất chỉ đạt 90% là:
105000000.90%
=94500000(g)
=94,5 tấn
Mình không biết là đúng hay sai nha
Cảm ơn bạn nka! Nhưng tiếc là mình đã hoàn thành bài này xong rồi.

Khối lượng Fe có trong gang là mFe = 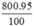 = 760 (tấn)
= 760 (tấn)
Khối lượng sắt thực tế cần để sản xuất gang (bị hao hụt 1%)
mFe = 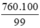 = 767,68 (tấn)
= 767,68 (tấn)
Fe3O4 + 4C → 4CO + 3Fe
232 3.56
x = ? 767,68 (tấn)
Khối lượng Fe3O4 là mFe3O4 = 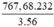 = 1060,13 (tấn)
= 1060,13 (tấn)
Khối lượng quặng manhetit là m = 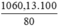 = 1325,163 (tấn)
= 1325,163 (tấn)
AlO là sao em ơi
nhôm ô xít ạ