hòa tan hoàn toàn 14,3 gam hỗn hợp gòm Al và FeCO3 = dd h2so4 loãng dư thì kl dd sau p ứng tăng so h2so4 bđ 9,6 gam . tính kl Al va feco3 trg X ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài 1:
PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)=n_{Fe}\)
\(\Rightarrow\%m_{Fe}=\dfrac{0,1\cdot56}{37,6}\cdot100\%\approx14,89\%\)
\(\Rightarrow\%m_{Fe_2O_3}=85,11\%\)
Bài 3:
PTHH: \(2HNO_3+Ba\left(OH\right)_2\rightarrow Ba\left(NO_3\right)_2+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{HNO_3}=0,05\cdot1=0,05\left(mol\right)\\n_{Ba\left(OH\right)_2}=\dfrac{342\cdot5\%}{171}=0,1\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,05}{2}< \dfrac{0,1}{1}\) \(\Rightarrow\) Axit p/ứ hết, Bazơ còn dư sau p/ứ
\(\Rightarrow\) Dung dịch sau p/ứ làm quỳ tím hóa xanh
Theo PTHH: \(n_{Ba\left(NO_3\right)_2}=\dfrac{1}{2}n_{HNO_3}=0,025\left(mol\right)\) \(\Rightarrow m_{Ba\left(NO_3\right)_2}=0,025\cdot261=6,525\left(g\right)\)

mFeCO3= 9/38 x 15,2= 3,6(g) -> nFeCO3= 3,6/116= 14/29(mol)
=> mMg= 15,2- 3,6= 11,6(g) -> nMg=11,6/24= 29/60(mol)
PTHH: FeCO3 + H2SO4 -> FeSO4 + CO2 + H2O
14/29____________14/29_____________14/29(mol)
Mg + H2SO4 -> MgSO4 + H2
29/60____29/60____________29/60(mol)
Ta có:
\(M_Y=\dfrac{\dfrac{14}{29}.44+\dfrac{29}{60}.2}{\dfrac{14}{29}+\dfrac{29}{60}}=22,988\left(\dfrac{g}{mol}\right)\\ \rightarrow d_{\dfrac{Y}{H2}}=\dfrac{22,988}{2}=11,494\)
nH2SO4(p.ứ)=14/29 + 29/60=0,966(mol)
Gọi x,y lần lượt là số mol FeCO3 và Mg
Ta có : \(\left\{{}\begin{matrix}116x+24y=15,2\\\dfrac{116x}{24y}=\dfrac{9}{29}\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=\dfrac{9}{290}\\y=\dfrac{29}{60}\end{matrix}\right.\)
\(FeCO_3+H_2SO_4\rightarrow FeSO_4+CO_2+H_2O\)
\(\dfrac{9}{290}\)------>\(\dfrac{9}{290}\)--------------------->\(\dfrac{9}{290}\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(\dfrac{29}{60}\)----->\(\dfrac{29}{60}\)-------------------->\(\dfrac{29}{60}\)
=> \(M_Y=\dfrac{\dfrac{9}{290}.44+\dfrac{29}{60}.2}{\dfrac{9}{290}+\dfrac{29}{60}}=4,53\)
=>dY/H2= \(\dfrac{4,53}{2}=2,265\)
\(n_{H_2SO_4}=\dfrac{9}{290}+\dfrac{29}{60}=\dfrac{179}{348}\left(mol\right)\)

a, \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
b, \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT: \(n_{Mg}=n_{H_2}=0,1\left(mol\right)\Rightarrow m_{Mg}=0,1.24=2,4\left(g\right)\)
\(\Rightarrow m_{MgO}=4,4-2,4=2\left(g\right)\)
c, \(n_{MgO}=\dfrac{2}{40}=0,05\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{Mg}+n_{MgO}=0,15\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=0,15.98=14,7\left(g\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{14,7}{19,6\%}=75\left(g\right)\)

Đáp án B
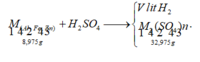
B T K L : n S O 4 2 - = m m u o i - m k l 96 = 32 , 975 - 8 , 975 96 = 0 , 25 ( m o l ) n H 2 = n S O 4 2 - = 0 , 25 m o l ⇒ V H 2 = 0 , 25 . 22 , 4 = 5 , 6 ( l í t )

\(a) Mg + H_2SO_4 \to MgSO_4 + H_2\\ 2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2\\ b) n_{Mg} = a(mol) ; n_{Al} = b(mol) \Rightarrow 24a + 27b = 7,5(1)\\ n_{H_2} = a + 1,5b = \dfrac{7,84}{22,4} = 0,35(2)\\ (1)(2) \Rightarrow a = 0,2 ; b = 0,1\\ \%m_{Mg} = \dfrac{0,2.24}{7,5}.100\% = 64\%\\ \%m_{Al} = 100\% - 64\% = 36\%\)

TL:
2Al + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2 (1)
0,2 0,3 mol 0,1 mol 0,3 mol
Al2O3 + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2O (2)
0,2 mol 0,6 mol 0,2 mol
Số mol của Al = 2/3 lần số mol của H2 (0,3 mol) = 0,2 mol. Do đó, số mol của Al2O3 = (25,8 - 27.0,2)/102 = 0,2 mol.
a) Sau phản ứng, số mol của Al2(SO4)3 thu được là 0,3 mol, do đó khối lượng = 102,6 gam.
b) Số mol H2SO4 = 0,9 mol, do đó khối lượng dd = 98.0,9.100/19,6 = 450 gam.
c) Khối lượng dd sau phản ứng = 450 + 25,8 - 2.0,3 = 475,2 gam.
Do đó: C% (Al2(SO4)3) = 102,6/475,2 = 21,59%.
