trong công nghiệp người ta điều chế HNO3 theo sơ đồ sau : \(NH_3\rightarrow NO\rightarrow NO_2\rightarrow HNO_3\) . biết hiệu suất của toàn bộ quá trình điều chế HNO3 là 70% , từ 22,4 lít NH3 ( điều kiện tiêu chuẩn ) sẽ điều chế được bao nhiêu gam HNO3 ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


10.a)(1) N2 + 3H2 \(\underrightarrow{t^o,p,xt}\)2NH3
(2) 4NH3 + 5O2 \(\underrightarrow{850^oC-900^oC,Pt}\) 4NO + 6H2O
(3) 2NO + O2 → 2NO2
(4) 4NO2 + O2 + 2H2O → 4HNO3
b) b/ Khối lượng HNO3 nguyên chất là: \(m_{HNO_3}=3,15\left(kg\right)\)
NH3-----> NO------>NO2------>HNO3
17---------------------------------->63
0,85 (kg)<---------------------3,15 (kg)
Lượng NH3 thực tế là:
\(m_{NH_3} = \dfrac{0,85.100}{79.356}.\dfrac{100}{85}=1,26\left(kg\right)\)
\(V_{NH_3} = \dfrac{1,26}{17}.22,4=1,66\left(m^3\right)\)

\(\text{Ta có 2 N2 ----> 1 HNO3}\)
..............56.................63
................x.......................1000
\(\Rightarrow\text{x=(1000.56)/63=888,889 kg}\)
\(\Rightarrow\text{m N2 thực tế =888,889.100/75=1185,185 Kg}\)
\(\Rightarrow\text{V N2= 1185,185 .22,4/28=948,148 m^3 }\)

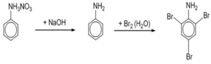
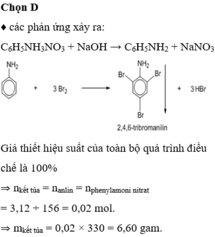
Chọn C
Ta có sơ đồ:
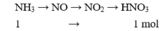
Do H = 80% nên số mol HNO 3 thu được là: 1.80% = 0,8 (mol)
Khối lượng HNO 3 thu được là: 0,8.63 = 50,4 gam.

\(m_{FeS_2}=0.6\left(tấn\right)=0.6\cdot10^3\left(kg\right)\)
\(n_{FeS_2}=\dfrac{0.6\cdot10^3}{120}=\dfrac{10^3}{200}\left(kmol\right)\)
Dựa vào sơ đồ phản ứng :
\(n_{H_2SO_4}=2n_{FeS_2}=2\cdot\dfrac{10^3}{200}=\dfrac{10^3}{100}=10\left(kmol\right)\)
\(m_{H_2SO_4\left(tt\right)}=10\cdot\dfrac{98}{80\%}=1225\left(kg\right)\)
\(m_{dd_{H_2SO_4}}=\dfrac{1225}{98\%}=1250\left(kg\right)=12.5\left(tấn\right)\)
\(m_{FeS_2}=\dfrac{1.60}{100}=0,6\left(tấn\right)\)
=> \(m_{FeS_2\left(pư\right)}=\dfrac{0,6.80}{100}=0,48\left(tấn\right)\)
Cứ 1 mol FeS2 điều chế được 2 mol H2SO4
=> 120g FeS2 điều chế được 196g H2SO4
=> 0,48 tấn FeS2 điều chế được 0,784 tấn H2SO4
=> \(m_{ddH_2SO_4}=\dfrac{0,784.100}{98}=0,8\left(tấn\right)\)

a. 6NH3 + 5O3 --> 6NO + 9H2O
b. 2S + HNO3 -to-> 2NO + H2SO4
c. 4NO2 + O2 + 2H2O --> 4HNO3
d. FeCl3 + 3AgNO3 --> Fe(NO3)3 + 3AgCl
e. 3NO2 + H2O -to-> 2HNO3 + NO
f. 3Ba(NO3)2 + Al2(SO4)3 --> 3BaSO4 + 2Al(NO3)3
a. 6NH3 + 5O3 \(\rightarrow\) 6NO + 9H2O
b. 2S + HNO3 \(\underrightarrow{to}\) 2NO + H2SO4
c. 4NO2 + O2 + 2H2O \(\rightarrow\) 4HNO3
d. FeCl3 + 3AgNO3 \(\rightarrow\) Fe(NO3)3 + 3AgCl
e. 3NO2 + H2O \(\underrightarrow{to}\) 2HNO3 + NO
f. 3Ba(NO3)2 + Al2(SO4)3 \(\rightarrow\) 3BaSO4 + 2Al(NO3)3

Đáp án C
Các phương trình điều chế HNO3 từ NH3
4NH3 + 5O2 ![]() 4NO + 6H2O
4NO + 6H2O
2NO + O2→2NO2
4NO2 + O2 + 2H2O→ 4HNO3
Theo bảo toàn nguyên tố N ta có:
nHNO3=nNH3=112 000/22,4=5000 mol
→mHNO3=315 000 gam= 315 kg
→ mddHNO3= 315.100/60=525 kg
Do hiệu suất bằng 80% nên mddHNO3 thực = mPT.80/100= 525.80/100=420 kg

a)\(4FeS_2+11O_2\underrightarrow{t^o}2Fe_2O_3+8SO_2\)
\(2SO_2+O_2\underrightarrow{t^o}2SO_3\)
\(SO_3+H_2O\rightarrow H_2SO_4\)
b)\(m_{H_2SO_4}=\dfrac{50\cdot49\%}{100\%}=24,5g\Rightarrow n_{H_2SO_4}=0,25mol\)
Từ quá trình trên: \(4FeS_2\rightarrow H_2SO_4\)
\(\Rightarrow n_{FeS_2}=\dfrac{1}{4}n_{H_2SO_4}=\dfrac{1}{4}\cdot0,25=\dfrac{1}{16}mol\)\
\(m_{FeS_2}=\dfrac{1}{16}\cdot120=7,5g\)
c)\(n_{NaOH}=0,3\cdot1=0,3mol\)
\(SO_2+2NaOH\rightarrow Na_2SO_3+H_2O\)
0,15 0,3 0,15
\(m_{Na_2SO_3}=0,15\cdot126=18,9g\)