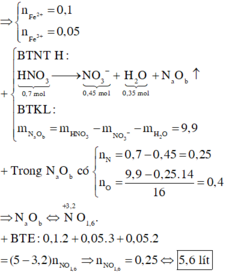
Cho 25,7 gam hỗn hợp(P) gồm Al,Fe,Cu phản ứng vừa đủ với 500ml dung dịch axit clohydric x mol/lít thu được 14,56 lít khí X(đktc) dung dịch Y và 6,4 gam chất rắn Z
a.Tính phần trăm về khối lượng kim loại trong (P)
b.Tính giá trị của X
c.Cho hoàn toàn Z vào 100ml dung dịch bạc nitrat 1,5M. Giả sử phản ứng xảy ra hoàn toàn. Tính khối lượng chất rắn sau phản ứng

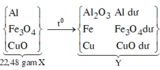
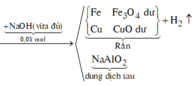
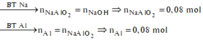
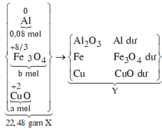
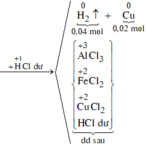
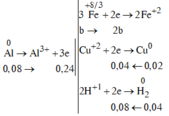

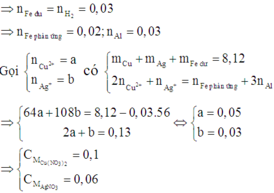

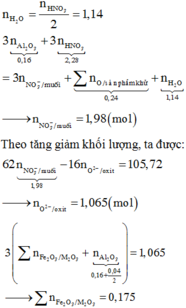
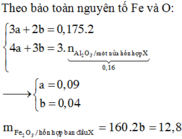
a) Chất rắn Z là Cu
\(\%m_{Cu}=\dfrac{6,4}{25,7}.100=24,9\%\)
Gọi x, y là số mol Al, Fe
2Al + 6HCl → 2AlCl3 + 3H2
Fe + 2HCl → FeCl2 + H2
\(\left\{{}\begin{matrix}\dfrac{3}{2}x+y=0,65\\27x+56y=19,3\end{matrix}\right.\)
=> x=0,3; y=0,2
\(\%m_{Al}=\dfrac{0,3.27}{25,7}.100=31,52\%\)
%mFe=43,58%
b)Khí X là H2
\(m_{H_2}=0,65.2=1,3\left(g\right)\)
c) \(Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag\)
\(n_{Cu}=0,1\left(mol\right);n_{AgNO_3}=0,15\left(mol\right)\)
Lập tỉ lệ : \(\dfrac{0,1}{1}>\dfrac{0,15}{2}\) => Sau phản ứng Cu dư
\(m_{cr}=m_{Cu\left(dư\right)}+m_{Ag}=\left(0,1-0,075\right).64+0,15.108=17,8\left(g\right)\)
a) mZ= mCu= 6,4(g) (Vì Cu không td dung dịch HCl)
=> m(Al, Fe)= 25,7 - 6,4= 19,3(g)
Đặt nAl=a(mol); nFe=b(mol) (a,b>0)
nH2= 14,56/22,4=0,65(mol)
PTHH: 2Al + 6 HCl -> 2 AlCl3 + 3 H2
a_________3a_____a_______1,5a(mol)
Fe + 2 HCl -> FeCl2 + H2
b____2b____b___b(mol)
Ta có hệ pt:
\(\left\{{}\begin{matrix}27a+56b=19,3\\3a+2b=0,65\end{matrix}\right.\)
Có vẻ số liệu lẻ, em có thể xem lại đề được không?