cho 16 gam một loại oxit sắt hợp chất của sắt và oxi tác dụng hết với khí hiđro thu được 11,2g fe tìm CTHHcua oxit sắt
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Gọi: CTHH của oxit là FexOy
Ta có: mO = 7,2 - mFe = 1,6 (g) \(\Rightarrow n_O=\dfrac{1,6}{16}=0,1\left(mol\right)\)
⇒ x:y = 0,1:0,1 = 1:1
→ CTHH cần tìm là FeO.

PTHH: 2xFe + yO2 ==(nhiệt)==> 2FexOy
Áp dụng định luật bảo toàn khối lượng:
=> mO2 = mFexOy - mFe = 3,2 - 2,24 = 0,96 gam
=> nO2 = 0,96 / 32 = 0,03 mol
=> nFe = \(\frac{0,03.2x}{y}=\frac{0,06x}{y}\)
=> mFe = \(\frac{0,06x}{y}.56=2,24\)
=> \(\frac{x}{y}=\frac{2}{3}\)
=> Công thức hóa học: Fe2O3
nFe=0.04 mol
2xFe + yO2 -> 2FexOy
2x : y: 2
=>nFexOy=nFe/x=0.04/x mol
NFexOy=3,2:(56x+16y)
=>0.04/x=3.2/(56x+16y)
<=>25x=(56x+16y):3.2
<=>25x=17.5x+5y
<=>7.5x=5y
<=>x/y=2/3
<=>Fe2O3

PTHH: 2xFe + yO2 ==(nhiệt)==> 2FexOy
Áp dụng định luật bảo toàn khối lượng:
=> mO2 = mFexOy - mFe = 3,2 - 2,24 = 0,96 gam
=> nO2 = 0,96 / 32 = 0,03 mol
=> nFe = \(\frac{0,03.2x}{y}=\frac{0,06x}{y}\)
=> mFe = \(\frac{0,06x}{y}.56=2,24\)
=> \(\frac{x}{y}=\frac{2}{3}\)
=> Công thức hóa học: Fe2O3
nFe=0.04 mol
2xFe + yO2 -> 2FexOy
2x : y: 2
=>nFexOy=nFe/x=0.04/x mol
NFexOy=3,2:(56x+16y)
=>0.04/x=3.2/(56x+16y)
<=>25x=(56x+16y):3.2
<=>25x=17.5x+5y
<=>7.5x=5y
<=>x/y=2/3
<=>Fe2O3

a) Gọi CTHH của oxit sắt là $Fe_2O_n$
$Fe_2O_n + nCO \xrightarrow{t^o} 2Fe +nCO_2$
$n_{Fe} = \dfrac{22,4}{56} = 0,2(mol)$
$\Rightarrow n_{Fe_2O_n} = \dfrac{1}{2}n_{Fe} = 0,2(mol)$
$M_{oxit} = 56.2 + 16n = \dfrac{32}{0,2}=160$
Suy ra : n = 3
Vậy oxit cần tìm là $Fe_2O_3$
b) $n_{CO_2} = \dfrac{3}{2}n_{Fe} = 0,6(mol)$
$CO_2 +C a(OH)_2 \to CaCO_3 + H_2O$
$n_{CaCO_3} = n_{CO_2} = 0,6(mol)$
$m_{CaCO_3} = 0,6.100 = 60(gam)$

\(a,3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\\ n_{Fe}=\dfrac{16,8}{56}=0,3\left(kmol\right)\\ n_{O_2}=\dfrac{2}{3}.0,3=0,2\left(kmol\right)\\ V_{O_2\left(\text{đ}ktc\right)}=0,2.1000.22,4=4480\left(l\right)\\ n_{Fe_3O_4}=\dfrac{1}{3}.0.3=0,1\left(kmol\right)\\ m_{Fe_3O_4}=232.0,1=23,2\left(kg\right)\)

\(n_{Mg}=\dfrac{6}{24}=0,25\left(mol\right)\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ 0,25.........0,5.........0,25.......0,25\left(mol\right)\\ a.V_{H_2\left(đktc\right)}=0,25.22,4=5,6\left(l\right)\\ b.m_{HCl}=0,5.36,5=18,25\left(g\right)\\ c.n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\\ Fe_2O_3+3H_2\underrightarrow{^{to}}2Fe+3H_2O\\ Vì:\dfrac{0,25}{3}< \dfrac{0,1}{1}\\ \Rightarrow Fe_2O_3dư\\ n_{Fe}=\dfrac{2}{3}.0,25=\dfrac{1}{6}\left(mol\right)\\ \Rightarrow m_{Fe}=\dfrac{1}{6}.56\approx9,333\left(g\right)\)
a,\(n_{Mg}=\dfrac{6}{24}=0,25\left(mol\right)\)
PTHH: Mg + 2HCl → MgCl2 + H2
Mol: 0,25 0,5 0,25
\(\Rightarrow V_{H_2}=0,25.22,4=5,6\left(l\right)\)
b,\(m_{HCl}=0,5.36,5=18,25\left(g\right)\)
c,\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
PTHH: Fe2O3 + 3H2 → 2Fe + 3H2O
Mol: 0,25 \(\dfrac{1}{6}\)
Ta có: \(\dfrac{0,1}{1}>\dfrac{0,25}{3}\)⇒ Fe2O3 dư, H2 hết
\(m_{Fe}=\dfrac{1}{6}.56=9,33\left(g\right)\)

Câu 1:
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\n_{HCl}=\dfrac{43,8}{36,5}=1,2\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{1,2}{2}\) \(\Rightarrow\) HCl còn dư, Fe p/ứ hết
\(\Rightarrow n_{H_2}=0,2\left(mol\right)\) \(\Rightarrow V_{H_2}=0,2\cdot22,4=4,48\left(l\right)\)
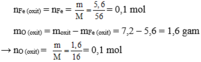
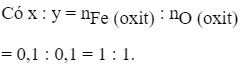
\(n_{Fe}=0,2mol\)
\(Fe_xO_y+yH_2\rightarrow xFe+yH_2O\)
\(\dfrac{0,2}{x}\)..........................0,2
\(M_{Fe_xO_y}=\dfrac{16}{\dfrac{0,2}{x}}=80x\Leftrightarrow56x+16y=80x\Leftrightarrow\dfrac{x}{y}=\dfrac{2}{3}\)
\(\Rightarrow x=2;y=3\)
Oxit sắt là: \(Fe_2O_3\)
Đặt CTHH: FexOy
\(Fe_xO_y+yH_2\underrightarrow{t^o}xFe+yH_2O\)
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(n_{Fe_xO_y}=\dfrac{0,2}{x}\left(mol\right)\)
\(M_{Fe_xO_y}=\dfrac{16}{\dfrac{0,2}{x}}=80x\)
\(56x+16y=80x\)
\(\Leftrightarrow16y=24x\)
\(\Leftrightarrow\)\(\dfrac{x}{y}=\dfrac{16}{24}=\dfrac{2}{3}\)
\(\Rightarrow x=2;y=3\)
CTHH của oxit sắt: Fe2O3