hòa tan hoàn toàn 3,6 gam Mg trong 500 ml dung dịch HNo3 0,8M, phản ứng kết thúc thu được 448 ml một khí X (đktc) và dung dịch Y có khối lượng lớn hơn khối lượng dung dịch HNO3 ban đầu là 3,04 gam. để phản ứng hết với các chất trong Y cần vừa đủ Vml dung dịch NaOH 2M. tính V
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D
Bảo toàn khối lượng: mdung dịch tăng = mMg – mX ⇒ mX = 3,6 – 3,04 = 0,56(g).
⇒ MX = 0,56 : 0,02 = 28 (N2)
Chú ý: "hòa tan hoàn toàn" ⇒ Mg hết.
Bảo toàn electron: 2nMg = 10nN2 + 8nNH4NO3 ⇒ nNH4NO3 = 0,0125 mol.
Bảo toàn nguyên tố Nitơ: ∑nNO3–/Y = 0,4 – 0,02 × 2 – 0,0125 = 0,3475 mol.
⇒ Bảo toàn nguyên tố Natri: nNaOH = nNaNO3 = 0,3475 mol ⇒ V = 173,75 ml

đáp án D
Ta có mKhí = mMg – mdd tăng = 0,56 gam
⇒ MKhí = 0,56 ÷ 0,02 = 28 ⇒ X là khí N2.
Bảo toàn e có nNH4NO3 = (2nMg – 10nN2) ÷ 8 = 0,0125
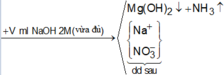
+ Nhận thấy cuối cùng Na sẽ đi về muối NaNO3 ⇒ Tìm ∑nNO3 có trong dung dịch Y.
Bảo toàn nito ta có nNO3/Y = nHNO3 – 2nN2 – nNH4 = 0,3475 mol.
⇒ nNaOH = 0,3475 mol ⇒ VNaOH = 0,17375 lít = 175,75 ml ⇒ Chọn D

Đáp án D
Bảo toàn khối lượng: mdung dịch tăng = mMg – mX ⇒ mX = 3,6 – 3,04 = 0,56(g).
⇒ MX = 0,56 ÷ 0,02 = 28 (N2) || Chú ý: "hòa tan hoàn toàn" ⇒ Mg hết.
► Bảo toàn electron: 2nMg = 10nN2 + 8nNH4NO3 ⇒ nNH4NO3 = 0,0125 mol.
Bảo toàn nguyên tố Nitơ: ∑nNO3–/Y = 0,4 – 0,02 × 2 – 0,0125 = 0,3475 mol.
||⇒ Bảo toàn nguyên tố Natri: nNaOH = nNaNO3 = 0,3475 mol ⇒ V = 173,75 ml

Chọn đáp án D
Ta có mKhí = mMg – mdd tăng = 0,56 gam
⇒ MKhí = 0,56 ÷ 0,02 = 28 ⇒ X là khí N2.
Bảo toàn e có nNH4NO3 = (2nMg – 10nN2) ÷ 8 = 0,0125
+ Nhận thấy cuối cùng Na sẽ đi về muối NaNO3 ⇒ Tìm ∑nNO3 có trong dung dịch Y.
Bảo toàn nito ta có nNO3/Y = nHNO3 – 2nN2 – nNH4 = 0,3475 mol.
⇒ nNaOH = 0,3475 mol ⇒ VNaOH = 0,17375 lít = 175,75 ml ⇒ Chọn D

Đáp án D
nMg = 0,15 mol ; nHNO3 = 0,4 mol ; nX = 0,02 mol
mX = 3,6 – 3,04 = 0,56g => MX = 28g (N2)
Bảo toàn e : nNH4NO3 = 1/8 (0,15.2 – 0,02.10) = 0,0125 mol
Bảo toàn Nito : nHNO3(Y) = 0,4 – (2nMg + 2nN2 + 2nNH4NO3) = 0,035 mol
nNaOH = nHNO3 (Y) + 2nMg + nNH4NO3 = 0,3475 mol
=> Vdd NaOH = 173,75 ml


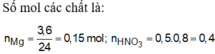
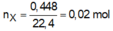
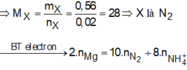
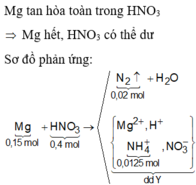
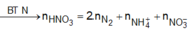


Xét phản ứng Mg tác dụng với dd HNO3, nhận thấy mY tăng=mMg - mX
suy ra mX=3,6-3,04=0,56(gam)
lại có nX=0,448/22,4=0,02(mol) \(\Rightarrow\) MX=0,56/0,02=28
\(\Rightarrow\) X là khí N2
Dễ dàng tìm được dung dịch Y chứa Mg(NO3)2 ; NH4NO3 ; HNO3 dư
Bạn dùng bảo toàn e để tìm số mol NH4NO3
dùng bảo toàn nguyên tố N để tìm HNO3 dư
\(n_{NaOH}=n_{NH_4NO_3}+2n_{Mg\left(NO_3\right)2}+n_{HNO_3dư}\)