Cho a gam hỗn hợp A gồm oxit FeO, CuO, Fe2O3 có số mol bằng nhau tác dụng hoàn toàn với lượng vừa đủ 250ml dung dịch HNO3 khi đun nóng nhẹ, thu được dung dịch B và 3,316 lít (đktc) hỗn hợp khí C gồm NO2 và NO có tỉ khối so với khí hidro là 20,143. Tính a
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Theo gt ta có: $n_{NO_2}=0,09(mol);n_{NO}=0,05(mol)$
Quy hỗn hợp về Fe (4x mol); Cu (x mol); O (6x mol)
Bảo toàn e ta có: $4x.3+2x-6x.2=0,24$
$\Rightarrow x=0,12(mol)$
$\Rightarrow a=46,08(g)$
Dùng phương trình $H^+$ suy ra $n_{HNO_3}=1,82(mol)$
$\Rightarrow C_{M/HNO_3}=7,28M$

a) Gọi \(\left\{{}\begin{matrix}n_{NO_2}=a\left(mol\right)\\n_{NO}=b\left(mol\right)\end{matrix}\right.\)
Ta lập HPT: \(\left\{{}\begin{matrix}a+b=\dfrac{3,136}{22,4}=0,14\\46a+30b=0,14\cdot19\cdot2\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,07\\b=0,07\end{matrix}\right.\)
Gọi \(n_{FeO}=n_{CuO}=n_{Fe_3O_4}=x\left(mol\right)\)
Coi hỗn hợp ban đầu gồm Fe (4x mol), Cu (x mol) và O (6x mol)
Bảo toàn electron: \(3n_{Fe}+2n_{Cu}=2n_O+n_{NO_2}+3n_{NO}\)
\(\Rightarrow12x+2x=12x+0,07+3\cdot0,07\) \(\Leftrightarrow x=0,14\)
\(\Rightarrow a=m_{hh}=72\cdot0,14+80\cdot0,14+232\cdot0,14=53,76\left(g\right)\)
b) Ta có: \(n_{HNO_3\left(p.ứ\right)}=n_{e\left(trao.đổi\right)}+n_{NO_2}+n_{NO}=0,07+0,07\cdot3+0,07+0,07=0,42\left(mol\right)\)

Đáp án B
Gọi a, b và c lần lượt là số mol của Mg, Fe3O4 và Fe(NO3)2.
Hỗn hợp khí Y gồm NO (0,07 mol) và H2 (0,03 mol).
Cho 8,66 gam X tác dụng với dung dịch hỗn hợp HCl và HNO3 thì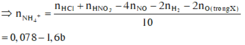
Cho Y tác dụng với NaOH, lọc kết tủa đun nóng thu được 10,4 gam hỗn hợp rắn gồm MgO (a mol) và Fe2O3 (1,5b + 0,5c) mol. Từ dữ kiện đề bài ta có hệ sau
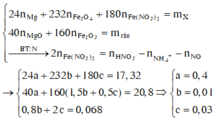

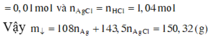




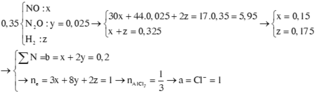
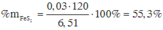
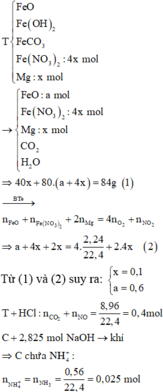

Ta có hệ
\(\begin{cases} n_{NO_2} + n_{NO}=\dfrac{3,136}{22,4}=0,14 \\ 46.n_{NO_2} + 30n_{NO}=2.20,143.0,14=5,64 \end{cases}\Leftrightarrow \begin{cases}x=0,09 \\y=0,05 \end{cases}\)
Đặt \(n_{FeO}=n_{CuO}=n_{Fe_3O_4}=z\)
Áp dụng bảo toàn e:\( z+z=0,09+0,05.3 \Leftrightarrow z=0,12\)
\(\Rightarrow a=0,12(72+80+232)=46,08 \)