nhúng 1 thanh sắt vào cốc đựng dung dịch Cuso4 cho đến khi màu xanh sau phản ứng thấy khối lượng kim loại tăng so với thanh sắt ban đầu là 0,8g
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đặt số mol Fe phản ứng là x (mol)
PTHH:
Fe + CuSO4 ===> FeSO4 + Cu
x................................................x
Theo đề ra, ta có:
mkim loại tăng = mCu(bám vào) - mFe(phản ứng) = 0,8
<=> 64x - 56x = 0,8
=> x = 0,1
=> mCu(bám vào) = 0,1 x 64 = 6,4 gam

Đáp án B
Fe + Cu2+ → Fe2+ + Cu
PT 1 mol 1 mol 1mol
ĐB 0,2 mol
mthanh sắt tăng = 64 – 56 = 8 gam
← 1,6 gam

Đáp án B
Fe + Cu2+ → Fe2+ + Cu
PT 1mol 1mol 1mol mthanh sắt tăng = 64- 56 = 8 gam
ĐB 0,2 mol ← 1,6 gam
=> V = 0,2/1 = 0,2 lít = 200 ml

Đáp án B
Fe + Cu2+ → Fe2+ + Cu
PT 1 mol 1 mol 1mol
mthanh sắt tăng = 64 – 56 = 8 gam
ĐB 0,2 mol ← 1,6 gam

Đáp án B
Fe + Cu2+ → Fe2+ + Cu
PT 1 mol 1 mol 1mol mthanh sắt tăng = 64 – 56 = 8 gam
ĐB 0,2 mol ← 1,6 gam

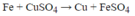
Theo phương trình cứ 56 gam Fe tan vào dung dịch thì có 64 gam Cu tách ra khỏi dung dịch. Thanh Fe tăng khối lượng nên khối lượng dung dịch phải giảm đi đúng bằng khối lượng thanh Fe tăng lên.
Vậy khối lượng thanh sắt tăng 0,8 gam khối lượng dung dịch giảm so với ban đầu 0,8 gam

Fe +CuSO4 → FeSO4 + Cu
Khối lượng thanh sắt tăng thêm đúng bằng khối lượng Cu thêm vào trừ đi khối lượng Fe tham gia phản ứng.
Gọi số mol của Fe tham gia phản ứng là x (mol)
Ta có : 64x−56x=51−50=1
=> x=0,125 (mol)
=> n CuSO4 pứ = n Fe(pứ) = 0,125 (mol)
\(CM_{CuSO_4}=\dfrac{0,125}{0,1}=1,25M\)
n FeSO4 = n Fe(pứ) = 0,125 (mol)
\(CM_{FeSO_4}=\dfrac{0,125}{0,1}=1,25M\)
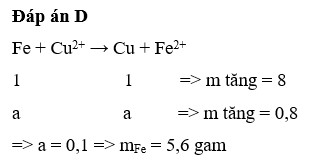
???????????