Hòa tan 13,2g hh bột Fe,FeO,và Fe2O3 vào dd HCl.sau phản ứng thu được chất răn A là kim loại ; 0,56l khí B và một dd C.Cho dd C tác dụng hết với dd NaOH dư thu được kết tủa D.Nung kết tủa D trong không khí đến khối lượng không đổi thu được 12g chất rắn.Mặt khác,nếu lấy khối lượng chất rắn A đúng bằng khối lượng của nó đem hòa tan hoàn trong H2SO4 đặc,nóng dư thu được 3,36l khí mùi xốc(đktc).tính %FeO trong hh.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bảo toàn Cu: `n_{Cu}=n_{CuSO_4}={50.9,6\%}/{160}=0,03(mol)`
`->m_{Cu}=0,03.64=1,92<2,48`
`->Y` chứa `Fe` dư và `Cu.`
`->m_{Fe\ du}=2,48-1,92=0,56(g)`
`Mg+CuSO_4->MgSO_4+Cu`
`Fe+CuSO_4->FeSO_4+Cu`
Đặt `n_{Mg}=x(mol);n_{Fe\ pu}=y(mol)`
Theo PT: `n_{Cu}=x+y=0,03(1)`
`MgSO_4+2NaOH->Mg(OH)_2+Na_2SO_4`
`FeSO_4+2NaOH->Fe(OH)_2+Na_2SO_4`
`Mg(OH)_2` $\xrightarrow{t^o}$ `MgO+H_2O`
`4Fe(OH)_2+O_2` $\xrightarrow{t^o}$ `2Fe_2O_3+4H_2O`
Theo PT: `n_{MgO}=x(mol);n_{Fe_2O_3}=0,5y(mol)`
`->40x+160.0,5y=2(2)`
`(1)(2)->x=0,01;y=0,02`
`->m=0,01.24+0,02.56+0,56=1,92(g)`
`\%m_{Mg}={0,01.24}/{1,92}.100\%=12,5\%`
`\%m_{Fe}=100-12,5=87,5\%`
`m_{dd\ spu}=1,92+50-2,48=49,44(g)`
`Z` gồm `MgSO_4:0,01(mol);FeSO_4:0,02(mol)`
`->C\%_{MgSO_4}={0,01.120}/{49,44}.100\%\approx 2,43\%`
`C\%_{FeSO_4}={0,02.152}/{49,44}.100\%\approx 6,15\%`

HD:
Câu 1.
Fe + 2HCl ---> FeCl2 + H2 (1)
FexOy + 2yHCl ---> xFeCl2y/x + yH2O (2)
Gọi a, b tương ứng là số mol của Fe và FexOy trong hh. Theo pt (1) số mol a = số mol H2 = 0,1 mol. Số mol HCl đã p.ứ ở pt (1) = 0,2 mol.
Số mol HCl ban đầu = 14,6.200/100.36,5 = 0,8 mol.
Khối lượng dd A = 200 + 17,2 - 2.1 = 215,2 g. Khối lượng dd B = 215,2 + 33 = 248,2 g.
Số mol HCl còn dư sau phản ứng = 2,92.248,2/100.36,5 = 0,19856 mol \(\approx\) 0,2 mol. Như vậy số mol HCl đã tham gia p.ứ = 0,8 - 0,2 = 0,6 mol.
Mà HCl đã p.ứ ở pt (1) là 0,2 mol nên số mol HCl đã p.ứ ở pt(2) là 0,4 mol.
Theo pt(2) số mol FexOy = 0,4/2y = 0,2/y mol. Mà khối lượng FexOy = 17,2 - 5,6 = 11,6 g. Ta có: (56x + 16y).0,2/y = 11,6. Suy ra: 56x + 16y = 58y hay x:y = 3:4
Oxit cần tìm là: Fe3O4.

a, PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{Cu}=24-m_{Fe}=12,8\left(g\right)\) \(\Rightarrow n_{Cu}=\dfrac{12,8}{64}=0,2\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{CuO}=n_{Cu}=0,2\left(mol\right)\\n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\)
⇒ m = mCuO + mFe2O3 = 0,2.80 + 0,1.160 = 32 (g)
b, \(\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{0,2.80}{32}.100\%=50\%\\\%m_{Fe_2O_3}=50\%\end{matrix}\right.\)
c, Theo PT: \(n_{H_2}=n_{CuO}+3n_{Fe_2O_3}=0,5\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,5.22,4=11,2\left(l\right)\)

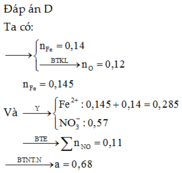
Số mol HNO3 có trong Y là
A. 0,54 mol. B. 0,78 mol. C. 0,50 mol. D. 0,44 mol.
Đây là câu khá kinh điển, nhưng năm nào luyện các bạn cũng sẽ thấy trong các đề thi thử. Các bạn phải giải chi tiết thì mới nhớ lâu.
Đầu tiên bàn về cách làm, vì hỗn hợp sắt và oxit qúa nhiều nên viết pt là không khả thi. Cách làm của mình là giả sử nó là hỗn hợp Fe và O.
Ta có 56x + 16y = 8.16g = phương trình khối lượng
Vì Y dư HNO3 nên mới tạo ra NO khi tiếp tục phản ứng với Fe nữa nên chắc chắn Fe lên +3 tất, O xuống -2, N từ +5 xuống +2 trong NO.
Vậy 3x = 2y + 1.344 * 3/22.4
Tại sao mình không tính luôn 1.344/22.4 vì máy tính sẽ tính cho bạn, bạn lập hệ là máy tính tự tính kết qủa. x = 0.12, y = 0.09, số mol NO = 0.06
Bây giờ các bạn chú ý đề bài lừa nè. Đây là TỐI ĐA Fe có thể tác dụng được, nên nó sẽ tác dụng với cả HNO3 cho lên +3 nhưng sau đó Fe lại tác dụng để xuống +2.
Vậy cuối cùng là Fe ở mức Fe2+.
0.12 Fe3+ tác dụng được với 0.06Fe để tạo ra Fe2+
5.04 = 0.09 mol Fe nên sẽ còn 0.03 mol tác dụng với HNO3.
0.03mol Fe cho 0.06 mol e để lên +2, nên số mol NO sẽ là 0.02.
Từ đó: NO = 0.06 + 0.02 = 0.08
Fe2+ = 0.09 + 0.12 = 0.21
HNO3 = NO3- + NO = 0.21*2 + 0.08 = 0.5
Vậy C
mình thắc mắc chút :tại sao 0,03 mol fe lại lên fe 2+ mà không phải là 3+

Đáp án C.
Chất rắn sau phản ứng gồm 2 kim loại → 2 kim loại đó là Cu và Fe , Al đã phản ứng hết → CuSO4 không dư → nCu = 0,105 mol => m= 6,72 gam → còn 1,12 gam là của Fe .
Phản ứng : Fe + 4HNO3 → Fe(NO3)3 + NO +2H2O
nFe = 0,02 mol → nHNO3= 0,08 mol .
n F e 3 + = 0,02 mol
chú ý phản ứng: Cu + 2Fe3+ → Cu2+ + 2Fe2+
⇒ 0,01 mol Cu + 0,02 mol Fe3+ → 0,01 mol Cu2+ và 0,02 mol Fe2+ )
Để HNO3 cần dùng là tối thiểu thì cần dùng 1 lượng hòa tan vừa đủ 0,105 – 0,01 = 0,095 mol Cu
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Từ đây tính được nHNO3= 0,095. 8 3 = 0,253 mol
→ tổng nHNO3 đã dùng là 0,253 + 0,08 = 0,333 mol
→ = 0,16667 lít = 166,67 ml