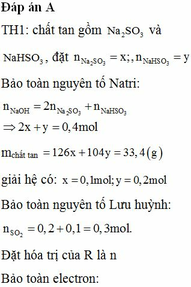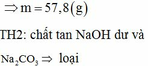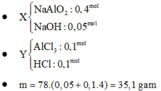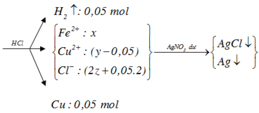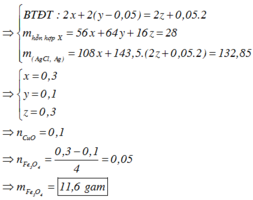Cho m gam kim loại M tan hoàn toàn trong 200 ml dung dịch HCl 0.5 M thu được dung dịch X và 2.016 lít H2 (đktc). Cho dung dịch AgNO3 dư vào dung dịch X thì thu được bao nhiêu gam kết tủa.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Giải thích:
nHCl = 0,2.0,5 = 0,1 (mol); nH2 = 2,24 :22,4 = 0,1 (mol)
=> nHCl < 2nH2
=> R là kim loại kiềm hoặc kiềm thổ, phản ứng hết với HCl sau đó phản ứng được với H2O
2R + 2nHCl → RCln + nH2↑
0,1 → 0,05
2R + 2nH2O → 2R(OH)n + nH2↑
0,1/n ←0,05
RCln + nAgNO3 → nAgCl↓ + R(NO3)n
2R(OH)n + 2nAgNO3 → nAg2O↓ + R(NO3)n + nH2O
0,1/n → 0,05
=> m↓ = mAgCl + mAg2O = 0,1.143,5 + 0,05. 232 = 25,95(g)
Chú ý:
Tránh sai lầm khi chỉ tính khối lượng kết tủa là AgCl khi đó sẽ ra 14,35 g => chọn ngay đáp án B sẽ dẫn đến sai lầm
Đáp án A

Đáp án : D
nH2 = 0,025 mol > nHCl = 0,02 mol
=> Kim loại M có thể tan trong nước tạo bazo
=> nCl = 0,02 mol ; nOH = 0,03 mol
=> Kết tủa gồm : 0,02 mol AgCl ; 0,015 mol Ag2O
=> m1 = 6,35g

n H 2 = 0,15
Như đã biết, khi cho kim loại Na hòa tan vào dung dịch HCl, sau khi axit hết mà kim loại còn dư thì kim loại sẽ tiếp tục tác dụng với nước:
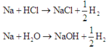
Quan sát hai phản ứng, ta có nNaCl + nNaOH = 0,3
Phản ứng tạo NaOH có thể xảy ra hoặc không nên ta gọi nNaCl = a; nNaOH = b (nếu không tạo ra NaOH thì b = 0).
Khi cho AgNO3 vào dung dịch X thì có các phản ứng tạo kết tủa:
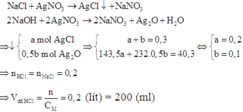
Đáp án B.

Gọi n là hóa trị của M.
\(n_{H_2} = 0,1(mol)\)
2M + 2nHCl → 2MCln + nH2
.........................\(\dfrac{0,2}{n}\).......0,1........(mol)
Suy ra: \(\dfrac{0,2}{n}(M + 35,5n) = 12,7\\\Rightarrow M = 28n\)
Với n = 2 thì M = 56(Fe)
\(n_{FeCl_2} = 0,1(mol)\)
FeCl2 + 2AgNO3 → 2AgCl + Fe(NO3)2
0,1...............................0,2........0,1................(mol)
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
0,1....................................................0,1...........(mol)
Suy ra m = mAgCl + mAg = 0,2.143,5 + 0,1.108 = 39,5(gam).Đáp án D

Đáp án D
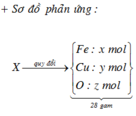
Kim loại không tan là Cu (0,05 mol) nên Y chứa FeCl2 (u) và CuCl2 (v)