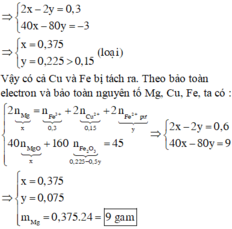Hoa tay lượng CuO trong dung dịch H2SO4 Loãng rồi thêm vào dung dịch tạo thành 3,6 gam Mg khuấy mạnh sau khi phản ứng kết thúc thu được hỗn hợp chất rắn R nặng 7,6 gam tính số gam chất rắn R
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
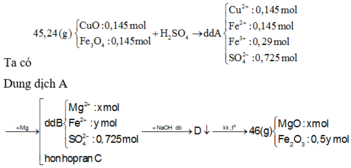
Ta có: m R a n = 46 = 40x+160.0,5y (1)
Bảo toàn điện tích ở dung dịch B: 2x+2y = 2.0,725 (2)
Giải (1) và (2) ta được: x = 0,3 mol , y = 0,425 mol
→ m = 0,3 . 24 = 7,2 (g) → giá trị gần nhất 7,4 (g)

Đáp án A
Ta có số mol CuO và Fe3O4 là 0,15 mol.
Cho lượng trên tan hết trong H2SO4 thu được dung dịch A chứa CuSO4 0,15 mol, FeSO4 0,15 mol và Fe2(SO4)3 0,15 mol.
Gọi số mol của Mg là x mol.
Cho Mg vào A ta có các trường hợp sau:
+Mg chỉ tác dụng với Fe2(SO4)3 thì lúc này rắn E chứa CuO 0,15 mol , MgO x mol và Fe2O3 .

![]()
Giải được x>0,225 vô lý (loại).
+Mg tác dụng với CuSO4 lúc này rắn E chứa Fe2O3 0,225 mol, MgO x mol và CuO 0,3-x mol.
![]()
Giải được x=0,375 >0,3 vô lý (loại).
+Mg tác dụng với FeSO4 lúc này rắn E chứa MgO x mol và Fe2O3

![]()
Giải được x=0,375 mol → m = 9 gam.

Đáp án C

Cho OH- vào B rồi lấy kết tủa nung thì rắn gồm :
MgO , CuO, Fe2O3 = 45 gam
⇒ m(MgO+CuO) = 45 − 0,225.160 = 9gam.
Vậy ta có 40x + 80(0,15−y) = 9
Bảo toàn e: 2x = 0,3y + 2y
⇒ x = 0,375 mol⇒ mMg = 9gam.

Đáp án A
Ta có số mol CuO và Fe3O4 là 0,15 mol.
Cho lượng trên tan hết trong H2SO4 thu được dung dịch A chứa CuSO4 0,15 mol, FeSO4 0,15 mol và Fe2(SO4)3 0,15 mol.
Gọi số mol của Mg là x mol.
Cho Mg vào A ta có các trường hợp sau:
+Mg chỉ tác dụng với Fe2(SO4)3 thì lúc này rắn E chứa CuO 0,15 mol, MgO x mol và Fe2O3 .
0 , 15 + 0 , 15 . 2 - 2 x 2 = 0 , 225 - x m o l → 0 , 15 . 80 + 40 x + ( 0 , 225 - x ) . 160 = 45
Giải được x>0,225 vô lý (loại).
+Mg tác dụng với CuSO4 lúc này rắn E chứa Fe2O3 0,225 mol, MgO x mol và CuO 0,3-x mol.
→ 0,225.160+40x+80(0,3-x)=45
Giải được x=0,375 >0,3 vô lý (loại).
+Mg tác dụng với FeSO4 lúc này rắn E chứa MgO x mol và Fe2O3
0 , 75 - x 2 = 0 , 375 - 0 , 5 x → 40 x + 160 ( 0 , 375 - 0 , 5 x ) = 45
Giải được x=0,375 mol → m = 9 gam.

Chọn D
Gọi nCuO = nFe3O4 = x (mol)
=> 80x + 232x = 46,8
=> x = 0,15 (mol)
=> nCuO = nFe3O4 = 0,15 (mol)
Bảo toàn nguyên tố => Dung dịch A chứa: 0,3 mol Fe3+; 0,15 mol Fe2+; 0,15 mol Cu2+; 0,75 mol SO42-
Nhận xét: Nếu hỗn hợp (CuO, Fe3O4) => (CuO, Fe2O3) thì khối lượng tăng lên, nhưng theo bài thì 45 < 46,8. Vậy phải có một phần kim loại Mg đã bị đẩy ra.
Mg + 2Fe3+ → Mg2+ + 2Fe2+
0,15 ←0,3→ 0,15 →0,3
Mg + Cu2+ → Mg2+ + Cu
Nếu toàn bộ Cu2+ đã bị đẩy ra thì B chứa Mg2+ (0,3); Fe2+ (0,45)
=> mE = mMgO + mFe2O3 = 48 > 45 gam
Nếu Cu2+ chưa hết thì m rắn > 48 gam ( Do CuO thế chỗ MgO thì khối lượng càng tăng). Vậy phải có 1 phần Fe bị đẩy ra.
Mg + Fe2+ → Mg2+ + Fe
x → x →x → x
=> mE = 40( 0,3 + x) + 160 (0,45 – x)/ 2 = 45
=> x = 0,075
=> nMg = 0,3 + x = 0,375
=> m = 9 gam (gần nhất với 8,8 gam)