2) Cho các hợp chất KMnO4, MnO2, HCl. Viết các phương trình phản ứng điều chế khí clo từ các chất trên. Thể tích khí clo thu được ở phản ứng nào nhiều hơn khi:
a. Khối lượng KMnO4 và MnO2 bằng nhau.
b. Số mol KMnO4 và MnO2 bằng nhau.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Giả sử lấy lượng mỗi chất là a gam
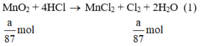
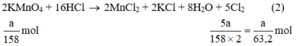
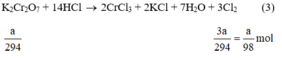
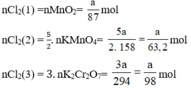
Ta có: 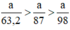
Lượng Cl2 điều chế được từ pt (2) nhiều nhất.
Vậy dùng KMnO4 điều chế được nhiều Cl2 hơn.
b) Nếu lấy số mol các chất bằng a mol
Theo (1) nCl2(1) = nMnO2 = a mol
Theo (2) nCl2(2) = 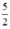 . nKMnO4 = 2,5a mol
. nKMnO4 = 2,5a mol
Theo (3) nCl2(3) = 3. nK2Cr2O7 = 3a mol
Ta có: 3a > 2,5a > a.
⇒ lượng Cl2 điều chế được từ pt (3) nhiều nhất.
Vậy dùng K2Cr2O7 được nhiều Cl2 hơn.

a) - Nếu dùng KMnO4:
2 KMNO4 + 16 HCl = 2 KCl + 2 MnCl2 + 8 H2O + 5 Cl2 (1)
- Nếu dùng MnO2:
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O (2)
Theo pt ta thấy (1) tạo ra 5Cl2 còn pư (2) chỉ tạo 1Cl2, chứng tỏ (1) tạo ra nhiều clo hơn (2).
b) giả sử số mol của KMnO4 và MnO2 là 0.2 mol
2 KMNO4 + 16 HCl = 2 KCl + 2 MnCl2 + 8 H2O + 5 Cl2 (1)
0.2.................................................................................0.5
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O (2)
0.2........................................0.2
Ta thấy số mol Cl2 ở (1) lớn hơn số mol Cl2 ở (2), suy ra pư (1) tạo nhiều clo hơn (2).
c) Từ (1) và (2) ta thấy:
Số mol HCl (1) lớn gấp 4 lần số mol HCl ở (2), suy ra ở pư (1) tiêu tốn HCl hơn pư (2).
Để thu được nhiều Clo hơn ta nên dùng pư (1) , còn muốn tiết kiệm HCl ta nên dùng MnO2.

Đáp án C
Với bài toán này ta suy luận nhanh như sau:Khí Clo thoát ra như nhau khi số mol e nhận như nhau:
Với PbO2 số oxi hóa Pb thay đổi 2 từ +4 xuống +2
Với MnO2 số oxi hóa Pb thay đổi 2 từ +4 xuống +2
Với KMnO4 số oxi hóa Mn thay đổi 5 từ +7 xuống +2
Với K2Cr2O7 số oxi hóa Cr thay đổi 6 từ +6.2 xuống +3.2
Với KClO3 số oxi hóa Clo thay đổi 6 từ +5 xuống – 1
Với CaOCl2 số oxi hóa Clo thay đổi 2 từ +1 xuống – 1
Vậy có 4 cặp thỏa mãn là :
PbO2 với MnO2 ; PbO2 với CaOCl2 ; MnO2 với PbO2; K2Cr2O7 với KClO3

\(Đặt:n_{MnO_2}=a\left(mol\right),n_{KMnO_4}=b\left(mol\right)\)
\(m_{hh}=87a+158b=37.96\left(g\right)\left(1\right)\)
\(n_{Cl_2}=\dfrac{10.08}{22.4}=0.45\left(mol\right)\)
\(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
\(n_{Cl_2}=a+2.5b=0.45\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.4,b=0.02\)
\(\%MnO_2=\dfrac{0.4\cdot87}{37.96}\cdot100\%=91.68\%\\\%KMnO_4=100-91.68=8.32\% \)
\(m_M=m_{KCl}+m_{MnCl_2}=0.02\cdot74.5+\left(0.4+0.02\right)\cdot126=54.41g\)

sao chị ko đáp lại câu trả lời của em ở câu trước , chị ko biết hả ?

Coi \(n_{KMnO_4} = n_{MnO_2} = 1(mol)\)
\(2KMnO_4 + 16HCl \to 2KCl + 2MnCl_2 + 5Cl_2 + 8H_2O(1)\\ MnO_2 + 4HCl \to MnCl_2 + Cl_2 + 2H_2O(2)\\ n_{Cl_2(1)} = \dfrac{5}{2}n_{KMnO_4} =2,5(mol)\\ n_{Cl_2(2)} = n_{MnO_2} = 1(mol)\\ \)
Vì : \(n_{Cl_2(1)} > n_{Cl_2(2)}\) nên KMnO4 sinh ra nhiều Clo hơn

a)
Giả sử lấy lượng mỗi chất là a gam.
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O (1)
2KMnO4 + 14 HCl → 2MnCl2 + 2KCl + 5Cl2 + 8H2O (2)
K2Cr2O7 + 14 HCl → 2CrCl2 + 2KCl + 3Cl2 + 7H2O (3)
Vậy dùng : KMnO4 điều chế được nhiều Cl2 hơn
b) Nếu số mol các chất bằng n mol
Theo (1) nmol MnO2 → nmol Cl2
Theo (2) nmol KMnO4 → 2,5 nmol Cl2
Theo (3) nmol K2Cr2O7 → 3nmol Cl2
Ta có: 3n > 2,5n > n
Vậy dùng K2Cr2O7 được nhiều hơn Cl2 hơn
a) Giả sử lấy lượng mỗi chất là a gam.
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O (1)
2KMnO4 + 14 HCl → 2MnCl2 + 2KCl + 5Cl2 + 8H2O (2)
K2Cr2O7 + 14 HCl → 2CrCl2 + 2KCl + 3Cl2 + 7H2O (3)
Vậy dùng : KMnO4 điều chế được nhiều Cl2 hơn
b) Nếu số mol các chất bằng n mol
Theo (1) nmol MnO2 → nmol Cl2
Theo (2) nmol KMnO4 → 2,5 nmol Cl2
Theo (3) nmol K2Cr2O7 → 3nmol Cl2
Ta có: 3n > 2,5n > n
Vậy dùng K2Cr2O7 được nhiều Cl2 hơn

a, PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
b, Ta có: \(n_{KMnO_4}=\dfrac{3,16}{158}=0,02\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{KMnO_4}=0,01\left(mol\right)\)
\(\Rightarrow m_{O_2}=0,01.32=0,32\left(g\right)\)
c, \(V_{O_2}=0,01.24,79=0,2479\left(l\right)\)
. 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O (1)
a/158 mol ............................................... a/63,2 mol
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O (2)
a/87 mol ..............................a/87mol
Ta có: a/63,2>a/87. Vậy khí clo ở phản ứng (1) thu được nhiều hơn phản ứng (2)
b. 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O (1’)
amol 2,5a mol
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O (2’)
amol a mol
Ta có 2,5a > a. Vậy dùng KMnO4 để điều chế thì thu được nhiều khí clo hơn so với dùng MnO2 khi lấy cùng khối lượng cũng như số mol.