Ngâm 1 lá Cu có khối lượng 10g trong 250g đe AgNO3 4%. Khi pư kết thúc lấy lá Cu ra thấy khối lượng giảm 17%. Xđ khối luongj Cu sau pư
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{AgNO_3}=\dfrac{250.4}{100.170}=\dfrac{1}{17}\left(mol\right)\)
=> \(n_{AgNO_3\left(pư\right)}=\dfrac{1}{17}.17\%=0,01\left(mol\right)\)
PTHH: Cu + 2AgNO3 --> Cu(NO3)2 + 2Ag
____0,005<--0,01--------------------->0,01
=> m = 12 - 0,005.64 + 0,01.108 = 12,76(g)
=> A

Khối lượng vật sau phản ứng = 10 + 0,01 x 108 – 0,005 x 64 = 10,76 g

PTHH : Cu + 2AgNO3 → Cu(NO3) + 2Ag
Gọi số mol Cu phản ứng là x => nAg = 2x
Khối lượng lá Cu tăng = mAg (bám vào) = mCu phản ứng tan ra = 2x.108 - 64x=1,52
=> x =0,01 mol
=> mCu phản ứng = 0,01.64 = 0,64 gam , mAgNO3 phản ứng = 0,02.170= 3,4 gam

( Không chắc nhé :)))
\(n_{Cu\left(NO_3\right)_2}=0,02.0,3=0,006\left(mol\right)\)
\(PTHH:Fe+Cu\left(NO_3\right)_2\rightarrow Fe\left(NO_3\right)_2+Cu\)
\(\left(mol\right)\) `0,006` `0,006` `0,006`
\(\Delta m\uparrow=0,006.64-0,006.56=0,048\left(g\right)\)
\(m_{vb}=45+0,048=45,048\left(g\right)\)

\(m_{Cu\left(pư\right)}=a\left(g\right)\\ Cu+2AgNO_3->Cu\left(NO_3\right)_2+2Ag\\ m_{AgNO_3\left(pư\right)}=0,17.0,04.250:108=\dfrac{a}{64}\\ a=1\left(g\right)\\ m_{vật}=5-1+\dfrac{2}{64}.108=7,375g\)

Khối lượng của AgNOg trong dung dịch là:
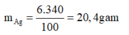
Phương trình phản ứng xảy ra:
![]()
Cứ 1 mol Cu phản ứng với 2 mol AgNO3, sinh ra 1 mol Cu(NO3)2 và 2 mol Ag, khối lượng kim loại tăng
![]()
Khối lượng AgNO3 đã tham gia phản ứng:
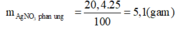
Từ (1)=> Số mol Cu đã phản ứng:
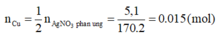
=> Khối lượng của vật sau phản ứng: m = 15 + 152.0,015 = 17,28 (gam).
Đáp án B.

\(Fe+CuSO_4\to FeSO_4+Cu\)
Đặt \(n_{CuSO_4}=x(mol)\)
\(\Rightarrow 64x-56x=2\\ \Rightarrow x=0,25(mol)\\ \Rightarrow n_{Fe}=n_{Cu}=0,25(mol)\\ \Rightarrow m_{Fe}=0,25.56=14(g);m_{Cu}=0,25.64=16(g)\)
pthh bạn tự viết nha
khối lượng dung dịch giảm chính là khối lượng kim loại tăng (định luật bảo toàn khối lượng )
=>khối lượng kim loại sau phản ứng là : 10 + 1. 7= 11. 7 g