Để điều chế khí oxi người ta nung các chất KClO3, KMnO4, HgO, KNO3. Tính khối lươ các chất cần phải lấy để khi nhiệt phân với hiệu suât phản ứng đều 90℅ thì thử được 5.6 lít oxi đktc ứng với mỗi trường hợp
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Số mol O2 cần điều chế trong thưc tế là:
\(n_{O_2}=\dfrac{5.6}{22.4}=0.25\left(mol\right)\)
Số mol O2 cần điều chế trong lý thuyết với hiệu suát 90% là:
\(n_{O_2lt}=\dfrac{0,2.100}{90}\approx0.222\left(mol\right)\)
- PTHH:\(2KMnO_4-^{\text{diều kiên nhiệt độ}}->K_2MnO_4+MnO_2+O_2\) (1)
\(2KClO_3-^{\text{diều kiên nhiệt độ}}->2KCl+3O_2\left(2\right)\)
\(2KNO_3-\text{diều kiên nhiệt độ}->2KNO_2+O_2\)(3)
Từ PTHH 1=> \(n_{KMnO_4}=2n_{O_2}=0,444\left(mol\right)\)
Khối lượng KMnO4 cần dùng là: \(m_{KMnO_4}=0,444.158=10.152\left(g\right)\)
Từ PTHH 2 => \(n_{KClO_3}=\dfrac{2}{3}n_{O_2}=0.148\left(mol\right)\)
Khối lượng KClO3 cần dùng là:
\(m_{KClO_3}=0,148.122,5=18.13\left(g\right)\)
Từ PTHH 3 => \(n_{KNO_3}=2n_{O_2}=0.444\left(mol\right)\)
=> Khối lượng KNO3 cần dùng là:
\(m_{KNO_3}=0,444.101=44.844\left(g\right)\)
Theo mk thì ngta k dùng KNO3 để điều chế oxi đâu vì muối Nitrat kiềm nó dễ nổ lắm

\(n_{O_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
1<------------------------------------0,5
=> \(m_{KMnO_4\left(pthh\right)}=1.158=158\left(g\right)\)
=> \(m_{KMnO_4\left(tt\right)}=\dfrac{158.100}{80}=197,5\left(g\right)\)

Bài 1; Tính số mol và khối lượng KMnO4 cần thiết để điều chế được;
PTHH: 2 KMnO4 -to-> K2MnO4 + MnO2 + O2
a, 24g khí oxi
Ta có: nO2= 24/32= 0,75(mol)
=> nKMnO4= 2.nO2=2.0,75=1,5(mol)
-> mKMnO4=1,5.158=237(g)
b, 5,6 lít oxi ở đktc
nO2= 5,6/22,4=0,25(mol)
=> nKMnO4=2.nO2=2.0,25=0,5(mol)
=> mKMnO4=0,5.158=79(g)

a)
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.5__________________________0.25
VO2 = 0.25*22.4 = 5.6 (l)
2KClO3 -to-> 2KCl + 3O2
0.5_______________0.75
VO2 = 0.75*22.4 = 16.8 (l)
2KNO3 -to-> 2KNO2 + O2
0.5________________0.25
VO2 = 0.25*22.4 = 5.6 (l)
2HgO -to-> 2Hg + O2
0.5____________0.25
VO2 = 0.25*22.4 = 5.6 (l)
b)
nKNO3 = 50/101 (mol)
2KNO3 -to-> 2KNO2 + O2
50/101______________25/101
VO2 = 25/101 * 22.4 = 5.54 (l)
nHgO = 50/217 (mol)
2HgO -to-> 2Hg + O2
50/217 _________25/217
VO2 = 2.58 (l)

\(n_{KClO_3\left(bd\right)}=\dfrac{55,125}{122,5}=0,45\left(mol\right)\)
=> \(n_{KClO_3\left(pư\right)}=\dfrac{0,45.85}{100}=0,3825\left(mol\right)\)
PTHH: 2KClO3 --to,MnO2--> 2KCl + 3O2
0,3825------------------->0,57375
=> \(V_{O_2}=0,57375.22,4=12,852\left(l\right)\)

Các chất được dùng để điều chế oxi: K C l O 3 ; K M n O 4 ; H 2 O ; HgO.
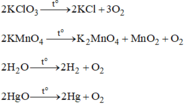

a)PTHH:2KClO\(_3\)➞\(^{t^o}\)2KCl+3O\(_2\)
b) n\(_{KClO_3}\)=\(\dfrac{m_{KClO_3}}{M_{KClO_3}}\)=\(\dfrac{12,15}{122,5}\)\(\approx\)0,1(m)
PTHH : 2KClO\(_3\) ➞\(^{t^o}\) 2KCl + 3O\(_2\)
tỉ lệ : 2 2 3
số mol : 0,1 0,1 0,15
V\(_{O_2}\)=n\(_{O_2}\).22,4=0,15.22,4=3,36(l)
c)PTHH : 2Zn + O\(_2\) -> 2ZnO
tỉ lệ : 2 1 2
số mol :0,3 0,15 0,3
m\(_{Zn}\)=n\(_{Zn}\).M\(_{Zn}\)=0,3.65=19,5(g)

nFe3O4 = 17.4/232 = 0.075 (mol)
3Fe + 2O2 -to-> Fe3O4
0.225__0.15_____0.075
mFe = 0.225*56=12.6 (g)
VO2 = 0.15*22.4 = 3.36 (l)
2KClO3 -to-> 2KCl + 3O2
0.1________________0.15
mKClO3 = 0.1*122.5 = 12.25 (g)