C và D là 2 nguyên tố đứng kế tiếp nhau ở 1 chu kì trong hệ thống tuần hoàn. Tổng số khối của chúng là 51. Số nơtron của D lớn hơn của C là 2 hạt. Trong nguyên tử C số electron bằng với số nơtron. Xác định vị trí và viết cấu hình e của C và D
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi số hạt của nguyên tố A là PA, số proton của nguyên tố B là PB
Theo bài ra ta có: A và B đứng kế tiếp nhau ở một chu kỳ
⇒ PB - PA = 1 (1)
Mặt khác: Tổng số proton của chúng là 25
⇒ PB + PA = 25 (2)
Từ (1) và (2) ta có hệ pt:
\(\left\{{}\begin{matrix}PB-PA=1\\PB+PA=25\end{matrix}\right.\)⇒\(\left\{{}\begin{matrix}PA=12\\PB=13\end{matrix}\right.\)
Cấu hình electron:
12A: 1s22s22p63s2
13B: 1s22s22p63s23p1

Gọi số proton, số notron trong C, D lần lượt là pC, nC, pD, nD (pC < pD)
Số p = Số e
Số khối = Số p + Số n
C và D đứng kế tiếp nhau trong cùng 1 chu kì → pD - pC = 1 (1)
Tổng số khối của C và D là 51 → pC + nC + pD + nD = 51 (2)
Số notron của D lớn hơn C là 2 → nD - nC = 2 (3)
\(\text{Từ (1), (2) và (3) → pC + nC = 24}\)
\(\text{ pD + nD = 27}\)
Trong nguyên tử C có số e = số n → pC = nC
\(\text{→ pC = nC = 12}\)
pD = 13; nD = 14
→ C là Magie; D là Nhôm

B
X và Y là hai kim loại cùng nhóm A.
=> Y có nhiều hơn X là 8 hoặc 18 hoặc 32 electron.
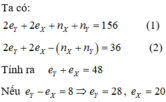
(không thuộc 2 chu kì)(loại).
![]()
Vậy 2 nguyên tố này là As và P, cùng thuộc nhóm VA và thuộc 2 chu kì (nhận).
![]()
(không thuộc 2 chu kì liên tiếp) (loại).
Vậy X là photpho (P).
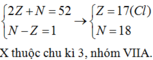
Tham khảo:
C và D là 2 nguyên tố đứng kế tiếp nhau ở 1 chu kỳ trong hệ thống tuần hoàn
⇒pC−pD=−1(I)⇒pC−pD=−1(I)
Trong nguyên tử C, số electron bằng với số notron
⇒eC=pC=nC⇒eC=pC=nC
Số notron của D lớn hơn C là 2 hạt
⇒nD=nC+2⇒nD=nC+2
⇒nD=pC+2⇒nD=pC+2
Tổng số khối của chúng là 51
⇒pC+pD+nC+nD=51⇒pC+pD+nC+nD=51
⇔pC+pD+pC+(pC+2)=51⇔pC+pD+pC+(pC+2)=51
⇔3pC+pD=49(II)⇔3pC+pD=49(II)
Giai (I) và (II) ⇒pC=12;pD=13⇒pC=12;pD=13
CHeC:1s22s22p63s2CHeC:1s22s22p63s2
=> C Ở Ô thứ 12, CK3, nhóm IIA
CHeD:1s^2 2s^2 2p^6 3s^2 3p^1
=> D Ở Ô thứ 13, CK3, nhóm IIIA